Новый подход к разработке противораковых препаратов: ученые продемонстрировали необычные движения антистрессового белка Hsp90

Новый подход к разработке противораковых препаратов: ученые продемонстрировали необычные движения антистрессового белка Hsp90 |
 |
| Актуальные темы - Вести из лабораторий |
| Автор: Administrator |
| 24.08.2010 13:07 |
|
Белок Hsp90 играет значительную роль в выживании клеток, подвергшихся стрессу. Механизм действия этого белка был открыт некоторое время назад учеными Технического университета Мюнхена (Technische Universitaet Muenchen - TUM), Германия, но недавно Hsp90 удивил немецких специалистов неожиданной моделью движений составляющих его частей. Результаты исследования опубликованы в текущем номере журнала Proceedings of the National Academy of Sciences и могут помочь ученым в разработке новых препаратов для лечения рака.
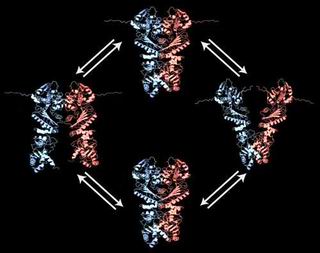
Своей неожиданной моделью движения антистрессовый белок Hsp90 удивил даже специалистов. (Credit: C. Ratzke und T. Hugel / TUM)
Белки – это молекулярные клеточные моторы. Наряду с выполнением других функций они транспортируют питательные вещества, приводят в движение наши мышцы, химически преобразуют различные соединения или управляют сборкой других белков. Так называемый белок теплового шока (heat shock protein) Hsp90 особенно важен для клеток, так как играет решающую роль во многих фундаментальных процессах, протекающих как в организме человека, так и в организмах низших животных, таких как бактерии и дрожжи. Например, он имеет огромное значение для сборки полипептидных цепочек в функциональные белки, обладающие строго определенной пространственной структурой. Синтез Hsp90 в организме особенно усиливается, когда клетки подвергаются воздействию стресса или токсичных веществ.
Антистрессовый белок Hsp90 является димером (состоит из двух идентичных субъединиц), каждый из которых можно приблизительно разделить на три сегмента: N-концевой домен наверху, средний домен и С-концевой домен в нижней части димера. Hsp90 получает необходимую для функционирования энергию с помощью медленного расщепления молекулы АТФ, топлива всех клеток. Во время этого процесса нити двух димеров расходятся в противоположных направлениях, хотя и всего на несколько нанометров. Исследователи из групп профессора Торстена Хугеля (Thorsten Hugel) (кафедра физики) и профессора Йоханнеса Бухнера (Johannes Buchner) (кафедра химии) TUM были хорошо знакомы с особенностями Hsp90: они первыми наблюдали ножницеобразные движения частей этого белка в режиме реального времени. Однако даже они были застигнуты врасплох: вместо обычных ножницеобразных движений у N-концевых доменов они увидели такие движения у обоих концов белка. Напоминая движения концов ножниц, Hsp90 «открывается» и «закрывается» и у С-концевых доменов – нечто до настоящего времени совершенно неизвестное для димеров. В своем новом исследовании ученые основывались на методе FRET (Förster Resonance Energy Transfer). Они связали две флуоресцентные молекулы со строго определенными точками в молекуле белка и использовали их в качестве молекулярной линейки: если один маркер флуоресцировал, то по мере их сближения второй начинал светиться со все большей интенсивностью. Используя этот эффект и специально сконструированный микроскоп, позволяющий изучать отдельные молекулы, они смогли наблюдать ножницеобразные наномасштабные движения обоих концов двух димеров Hsp90. Особенно интересным оказалось то, что двойные ножницеобразные движения у С- и N-терминалов тесно взаимосвязаны: димер Hsp90, очевидно, «открывается» и «закрывается» поочередно на каждом конце, напоминая движения кресла-качалки. «Это объясняет большую стабильность димера – иначе белок распался бы намного быстрее», - объясняет Торстен Хугель. Ученые были очень удивлены и механизмом, регулирующим скорость качательных движений: движение у С-конца регулируется связью АТФ с N-терминальным доменом. Ученые доказали это, лишив димер энергии АТФ. Исследователи пришли к выводу, что в Hsp90 происходят внутренние взаимодействия, охватывающие необычно большое расстояние - почти в 10 нанометров. Наблюдаемые модели движения и взаимодействия интересны не только с точки зрения фундаментальной науки, но и для медицинских исследований, так как белок Hsp90 является новой мишенью в терапии рака. На сегодня наиболее перспективными кандидатами в лекарственные препараты являются химические вещества, блокирующие связывание АТФ у N-терминального домена антистрессового белка. Однако эти химические соединения могут оказывать нежелательные побочные эффекты. Благодаря новым открытиям ученые из TUM теперь могут сконцентрировать свое внимание на С-концевой димеризации Hsp90. «Здесь находятся уникальные стыковочные сайты для противораковых препаратов, которые не будут иметь побочных эффектов», - считает Хугель. Посмотреть видео По материалам TUM-Forscher zeigen Wippbewegung bei Antistress-Protein Hsp90 Аннотация к статье: C. Ratzke, M. Mickler, B. Hellenkamp, J. Buchner and T. Hugel. Dynamics of heat shock protein 90 C-terminal dimerization is an important part of its conformational cycle Related Articles: |