|
Стволовые клетки – сырьевой материал организма. Это клетки, из которых создаются все остальные клетки со специализированными функциями. При определенных условиях в организме или в лаборатории стволовые клетки делятся, образуя дочерние клетки, которые могут стать либо новыми стволовыми клетками (самообновление), либо специализированными клетками (дифференциация) с более специфической функцией, такими как клетки крови, головного мозга, сердечной мышцы или кости. Стволовые клетки уникальны – ни одна другая клетка организма не обладает естественной способностью образовывать новые типы клеток. (Рис. allthingsstemcell.com)
Блокировав ключевой сигнал, ученые удержали эмбриональные стволовые клетки в недифференцированном состоянии
Хотя способность человеческих эмбриональных стволовых клеток (чЭСК) становиться зрелыми клетками любого типа – от нейрона до кардиомиоцита, фибробласта или остеобласта – бесспорно, имеет решающее значение для развития человеческого организма, не менее важным является и механизм удержания чЭСК в плюрипотентном состоянии до того момента, когда эта трансформация становится необходимой.
В статье, опубликованной в интернет-издании PNAS, ученые из Школы медицины Калифорнийского университета в Сан-Диего (University of California, San Diego School of Medicine) определили рецептор одного из ключевых генов и сигнальный путь, важные для поддержания недифференцированного состояния человеческих ЭСК.
Это открытие проливает новый свет на фундаментальную биологию человеческих ЭСК с их огромным потенциалом в качестве терапевтического инструмента и предлагает новую мишень для атаки на раковые стволовые клетки, которые в своем безудержном губительном росте, по-видимому, полагаются на эти рецептор и путь.
Исследование, возглавляемое Карлом Виллертом (Karl Willert), PhD, доцентом кафедры клеточной и молекулярной медицины, сфокусировано на роли высоко консервативного сигнального пути Wnt – большого семейства белков, давно признанного важнейшим регулятором самообновления стволовых клеток, – и, частности, на кодируемом рецепторе, известном как рецептор 7 семейства Frizzled, или FZD7.
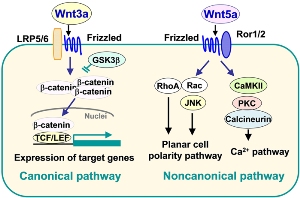
Канонический Wnt-сигналинг опосредует свое действие путем связывания со своими рецепторами Frizzled (FZD) и ко-рецепторами, LRP5/6. Это вызывает активацию внутриклеточного Dishevelled (Dvl), который, в свою очередь, ингибирует фермент гликоген-синтаза-киназа-3β (glycogen synthase kinase-3β, GSK3β). Это приводит к стабилизации и транслокации в ядро β-катенина, индуцируя транскрипцию генов через семейство факторов транскрипции LEF/TCF. В отсутствие Wnt-сигналинга комплекс, содержащий GSK3β, фосфорилирует β-катенин, что приводит к его деградации путем убиквитинирования. Wnt-сигналинг участвует в поддержании стволовых клеток в недифференцированном состоянии, однако, часто неясно, какой из Wnts и Wnt-рецепторов опосредует эту функцию. Американские ученые изучили роль в поддержании человеческих ЭСК в недифференцированном и плюрипотентном состоянии рецептора Wnt FZD7. По сравнению с популяциями дифференцированных клеток экспрессия FZD7 в недифференцированных клетках значительно повышена, и предотвращение его экспрессии или функции либо опосредованным короткой шпилечной РНК нокдауном, либо направленной против FZD7 молекулой антигенсвязывающего фрагмента (fab) выводит чЭСК из плюрипотентного состояния. FZD7-специфический fab блокирует сигналинг через белок Wnt3a за счет снижения уровней белка FZD7, предполагая, что FZD7 трансдуцирует Wnt-сигналы для активации Wnt/β-катенин сигналинга. Эти результаты показывают, что FZD7 кодирует регулятор плюрипотентного состояния и что для сохранения недифференцированного фенотипа человеческих ЭСК требуется эндогенный Wnt/β-катенин сигналинг через FZD7. (Рис. bioscience.org)
«Wnt-сигналинг через FZD7 необходим для поддержания недифференцированного состояния человеческих ЭСК», - объясняет доктор Виллерт. «Если блокировать функцию FZD7, вмешиваясь тем самым в путь Wnt, чЭСК выходят из недифференцированного и плюрипотентного состояния».
Исследователи доказали это с помощью белка со свойствами антитела, связывающегося с FZD7, препятствуя реализации его функции.
«Если функция FZD7 блокируется этим FZD7-специфическим соединением, человеческие ЭСК уже не могут получать Wnt-сигнал, требующийся для поддержания их недифференцированного состояния».
FZD7 является так называемым «онкофетальным белком», экспрессирующимся только в период эмбрионального развития и некоторыми человеческими опухолями. Другие исследования показали, что FZD7 может быть маркером раковых стволовых клеток и играет важную роль в стимуляции опухолевого роста. Если это так, считает доктор Виллерт, нарушение функции FZD7 в раковых клетках, скорее всего, будет препятствовать их развитию и росту так же, как это происходит в человеческих ЭСК.
Доктор Виллерт и его коллеги, в том числе почетный профессор Калифорнийского университета в Сан-Диего (University of California San Diego) Деннис Карсон (Dennis Carson), MD, из Sanford Consortium for Regenerative Medicine, планируют продолжить тестирование FZD7-блокирующего соединения в качестве потенциального препарата для лечения рака.
По материалам
Keeping Stem Cells Pluripotent
Оригинальная статья:
Antonio Fernandez, Ian J. Huggins, Luca Perna, David Brafman, Desheng Lu, Shiyin Yao, Terry Gaasterland, Dennis A. Carson, and Karl Willert. The WNT receptor FZD7 is required for maintenance of the pluripotent state in human embryonic stem cells
© «Как не дать стволовой клетке дифференцироваться». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Стволовые клетки.
Сигнальный путь Wnt играет ключевую роль в нейрогенезе во взрослом головном мозге
Related Articles: |













