|
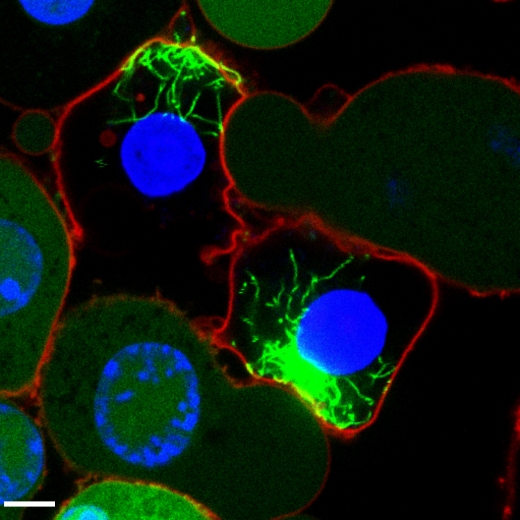
Всем инфламмасомам для активации каспазы-1 требуется адаптерный белок ASC (associated speck-like protein containing a CARD, подобный пятнышку регуляторный белок, ассоциированный с апоптозом и содержащий CARD-домен). Микробы или сигналы опасности активируют сенсоры инфламмасом, индуцирующие полимеризацию ASC и его сборку в большой белковый комплекс, называемый «пятнышком». ASC-пятнышки рекрутируют и активируют каспазу-1, индуцирующую созревание цитокина интерлейкина 1β (IL-1β) и пироптотическую гибель клеток. Профессор Лац и его коллеги установили, что после пироптоза ASC-пятнышки накапливались во внеклеточной среде, где они способствовали дальнейшему созреванию IL-1β. Кроме того, фагоцитоз ASC-пятнышек макрофагами индуцировал лизосомальное повреждение и нуклеализацию растворимого ASC, а также активацию IL-1β в клетках-реципиентах. ASC-пятнышки появлялись в физиологических жидкостях из воспаленных тканей, а у пациентов и у мышей с аутоиммунными патологиями вырабатывались аутоантителы к ASC-пятнышкам. Вместе эти результаты раскрывают внеклеточные функции ASC-пятнышек и ранее неизвестную форму межклеточной коммуникации. На снимке: макрофаги, содержащие активированные инфламмасомы. Ранее равномерно распределенные молекулы ASC (зеленые) образуют фибриллярные структуры. Ядра клеток окрашены синим; плазматические мембраны – красным. (Фото: Eicke Latz/Uni Bonn)
Белковые агрегаты распространяют воспаление
Даже после того, как клетка умирает, компоненты иммунной системы остаются активными и продолжают поддерживать воспалительные реакции. Международная группа ученых во главе с исследователями из Института врожденного иммунитета (Institut für Angeborene Immunität) при Университетской клинике Бонна (Universitätsklinikums Bonn) установила, как работает эта удивительная форма межклеточной коммуникации. Результаты исследования предполагают возможность потенциально нового подхода к лечению многих серьезных заболеваний, затрагивающих большую часть населения планеты, таких как подагра, атеросклероз и болезнь Альцгеймера. Эти интереснейшие результаты опубликованы в журнале Nature Immunology.
Когда живая иммунная клетка испытывает стресс, например, при обнаружении микробов или отложений кристаллов мочевой кислоты в суставах, холестерина в кровеносных сосудах или амилоидных бляшек в головном мозге при болезни Альцгеймера, так называемые инфламмасомы посылают «сигнал опасности». Инфламмасомы – большие мультибелковые комплексы, образующиеся, когда клетка находится в состоянии стресса. Инфламмасомы активируют фермент, стимулирующий синтез важных мессенджеров, которые, в свою очередь, являются триггером воспалительной реакции. В процессе этой активации пораженные иммунные клетки погибают, и, таким образом, воспалительная реакция должна прекратиться.
«Этот механизм, в первую очередь, защищает организм от инфекций и вредных воздействий», - поясняет профессор Айке Лац (Eicke Latz), директор Института врожденного иммунитета.

Профессор Айке Лац (Eicke Latz) (в центре) с сотрудниками своей лаборатории. (Фото: Barbara Frommann/Uni Bonn)
Удивительно, но результаты его нового исследования показывают, что инфламмасомы остаются активными даже тогда, когда клетки уже умерли. Ученым удалось продемонстрировать, что активированные инфламмасомы выполняют ферментативные функции и вне живой клетки и, таким образом, могут активировать дополнительные мессенджеры. В ходе своего рода цепной реакции инфламмасомы умерших клеток захватываются соседними клетками иммунной системы, где они активируют другие инфламмасомы.
В течение нескольких секунд после активации инфламмасомы образуют функциональные белковые комплексы, размеры которых могут достигать размеров бактерий.
«При стрессе или инфекции такой белковый комплекс провоцирует в клетке активацию провоспалительных мессенджеров, и, как мы теперь знаем, это же может происходить и вне клетки. Таким образом, может развиться очень быстрая воспалительная реакция, помогающая максимально быстро устранить нежелательное повреждение или микробных захватчиков», - объясняет ведущий автор статьи доктор Бернардо Франклин (Bernardo Franklin).
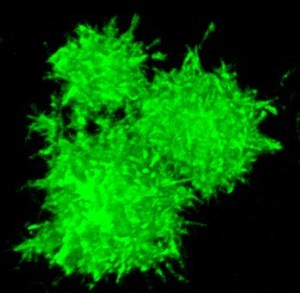
3D реконструкция трех ASC-пятнышек. (Фото: Bernard S. Franklin)
С помощью флуоресцентных маркеров исследователи пометили инфламмасому в клетках иммунной системы. Всякий раз, когда инфламмасома была активна, она образовывала флуоресцентный белковый комплекс, напоминающий маленькую светящуюся внутри клетки звездочку. Этот метод позволил ученым отследить судьбу инфламмасомы после смерти клетки и показать, что она по-прежнему остается активным интактным белковым комплексом, а также то, что по выходе из мертвой клетки она стимулирует воспалительную реакцию в соседних клетках. Кроме того, они установили, что эти внеклеточные комплексы накапливаются в легких пациентов с хроническими легочными заболеваниями.
«Как правило, инициируя воспалительную реакцию, иммунная система очень хорошо помогает в предотвращении повреждения тканей», - продолжает профессор Лац.
Однако избыточность таких реакций или их большая, чем необходимо, длительность могут способствовать развитию распространенных болезней западного мира, таких как подагра, болезнь Альцгеймера, диабет или атеросклероз. Открыв внеклеточные инфламмасомы, ученые обозначили интересный путь к разработке потенциально новых методов их лечения.
«Если нам удастся создать соответствующие антитела, вполне вероятно, мы сможем подавить внеклеточный сигнал инфламмасомы и таким образом удержать вредные хронические воспалительные реакции под контролем, не затрагивая необходимый внутриклеточный ответ», - считает ученый.
По материалам
Auch der Zelltod kann die Alarmkette nicht stoppen
Оригинальные статьи:
Bernardo S Franklin, Lukas Bossaller, Dominic De Nardo, Jacqueline M Ratter, Andrea Stutz, Gudrun Engels, Christoph Brenker, Mark Nordhoff, Sandra R Mirandola, Ashraf Al-Amoudi, Matthew S Mangan, Sebastian Zimmer, Brian G Monks, Martin Fricke, Reinhold E Schmidt, Terje Espevik, Bernadette Jones, Andrew G Jarnicki, Philip M Hansbro, Patricia Busto, Ann Marshak-Rothstein, Simone Hornemann, Adriano Aguzzi, Wolfgang Kastenmüller, Eicke Latz. The adaptor ASC has extracellular and 'prionoid' activities that propagate inflammation
Alberto Baroja-Mazo, Fatima Martín-Sánchez, Ana I Gomez, Carlos M Martínez, Joaquín Amores-Iniesta, Vincent Compan, Maria Barberà-Cremades, Jordi Yagüe, Estibaliz Ruiz-Ortiz, Jordi Antón, Segundo Buján, Isabelle Couillin, David Brough, Juan I Arostegui & Pablo Pelegrín. The NLRP3 inflammasome is released as a particulate danger signal that amplifies the inflammatory response
© «Открыта удивительная форма коммуникации клеток иммунной системы». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Вести из лабораторий. Письменное разрешение обязательно.
Related Articles: |













