Фото с сайта fotki.yandex.ru
Регенерация тканей как у саламандр и тритонов кажется предметом научной фантастики. Но это происходит в реальности. Почему мы, млекопитающие, не можем восстановить конечность или вырастить новую сердечную мышцу, когда это необходимо? Новое исследование предполагает, что для этого должна существовать веская причина: ограничение способности наших клеток вступать в клеточный цикл по собственному усмотрению – необходимое условие деления клеток для строительства новой ткани – снижает вероятность того, что они выйдут из-под контроля и приведут к образованию смертельно опасных раковых опухолей.
Ученые Медицинской школы Стэнфордского университета (Stanford University School of Medicine) сделали большой шаг к возможности вернуть способность к регенерации мышечным клеткам млекопитающих. Они достигли таких результатов в экспериментах на лабораторных мышах, заблокировав экспрессию всего двух генов, подавляющих развитие опухолей. Открытие может приблизить медицину к восстановительной терапии у людей – удивительно, но направив нас вниз по эволюционной лестнице.
«Тритоны очень эффективно восстанавливают свои ткани», - говорит научный сотрудник Института биологии стволовых клеток и регенеративной медицины (Institute for Stem Cell Biology and Regenerative Medicine) Стэнфордского университета (Stanford University) доктор философии Хелен Блау (Helen Blau). «Млекопитающие же просто вызывают жалость. Мы можем восстановить свою печень, и это все. До сегодняшнего дня то, как они это делают, оставалось тайной».

Ученые лаборатории Хелен Блау нашли способ помочь клеткам мышей восстанавливать ткань так, как это делают тритоны. (Фото: Steve Fisch)
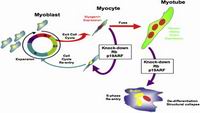
На фоне большого количества дискуссий об использовании взрослых или эмбриональных стволовых клеток для восстановления и омоложения тканей всего организма исследователи выбрали другой путь. Вместо стволовых клеток они изучали вопрос о том, можно ли заставить миоциты, неделящиеся обычно клетки мышц, снова войти в клеточный цикл и начать пролиферировать. Это очень важный вопрос, так как специализированные, или дифференцированные, клетки млекопитающих зафиксированы в стабильном состоянии, запрещающем клеточное деление. Достичь же регенерации без деления клеток не представляется возможным.
В противоположность млекопитающим некоторые виды амфибий способны заменять потерянные или поврежденные ткани, вступив в клеточный цикл, чтобы дать начало новым мышечным клеткам. При этом клетки сохраняют свою идентичность, оставаясь мышечными, что не позволяет им отклоняться от проторенного пути и становиться другими, менее полезными типами клеток.
Хелен Блау и работавший ранее в ее лаборатории доктор медицины Джейсон Померанц (Jason Pomerantz) решили выяснить, можно ли «уговорить» клетки млекопитающих следовать этим же путем. Однако, прежде всего они должны были установить, в чем заключается разница между вступающими в клеточный цикл клетками млекопитающих и саламандры. Одним из аспектов этого процесса является наличие класса белков, блокирующих опасное клеточное деление – так называемых супрессоров опухолей.
Предыдущие исследования показали, что супрессор опухоли ретинобластомы, или Rb, играет важную роль в предотвращении перехода многих типов специализированных клеток млекопитающих, включая найденные в мышцах, к неконтролируемому делению. Но эффект блокирования экспрессии Rb в клетках млекопитающих был непостоянен: в некоторых случаях Rb позволял клеткам снова вернуться к клеточному циклу, в то время как в других случаях этого не наблюдалось.
Проведя большую работу, ученые пришли к выводу, что можно использовать другой опухолевый супрессор – ARF. Как и Rb, ARF работает на торможение клеточного цикла в ответ на внутренние сигналы. Изучение эволюционного дерева дало исследователям ключевую подсказку. Они увидели, что впервые ARF появляется у кур. Его находят и у других птиц и млекопитающих, но не у животных подобных саламандрам, находящихся на более низких стадиях эволюции. Характерно, что он также отсутствует в линиях клеток, которые вступают в клеточный цикл при потере Rb, и экспрессируется на более низком, чем норма, уровне в печени млекопитающих – единственном органе, который восстанавливается у человека.
Основываясь на предыдущих работах на тритонах, Блау говорит: «Нам показалось, что они не имеют подобных ограничений роста. Мы предположили, что, возможно, в процессе эволюции человек приобрел опухолевые супрессоры, которых нет у низших животных, ценой способности к регенерации».
Как можно было предположить, Померанц и Блау обнаружили, что блокирование экспрессии и Rb и ARF позволяло отдельным миоцитам, изолированным от мышечной ткани, дедифференцироваться и начать деление. Когда ученые ввели клетки обратно в мышечную ткань мыши, мииоциты смогли слиться с существующими мышечными волокнами, но только если экспрессия Rb была восстановлена. Без Rb трансплантированные клетки пролиферировали слишком бурно и нарушали прежнюю структуру мышцы.
«Миоциты достигли точки невозврата», - говорит Блау. «Они не могут просто начать делиться снова. Но мы показали, что временное блокирование экспрессии всего двух генов может восстановить древнюю способность к регенерации мышц у млекопитающих».
Ключевым словом здесь является слово «временное». Из экспериментов на мышах ясно, что блокирование экспрессии опухолевых супрессоров в клетках млекопитающих - задача, не имеющая простого решения. Постоянное удаление этих белков приводит к неограниченному клеточному делению. Но временная и хорошо контролируемая их потеря – что и разработали исследователи – может стать полезным терапевтическим инструментом.
В дальнейшем ученые планируют выяснить, работает ли их метод на других типах клеток, например, на клетках поджелудочной железы или сердца, и смогут ли они получить подробные результаты в местах повреждения тканей. Если так, то временное включение клеточной пролиферации вполне может стать средством терапии большого количества различных заболеваний.
Исследование финансировалось Национальным институтом здравоохранения (National Institutes of Health) и Фондом Бакстера (Baxter Foundation).
По материалам
Newts' ability to regenerate tissue replicated in mouse cells by scientists