|
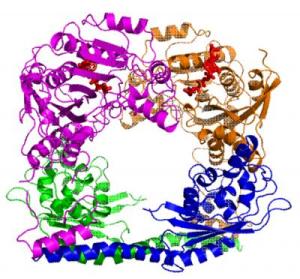
Гистон-ацетилтрансферазы (HATs) – ферменты, эпигенетически модифицирующие экспрессию генов. То, как они модифицируют свою мишень, зависит от их формы. Эта кольцевая структура образована двумя ацетилтрансферазами Rtt109 (показаны фиолетовым и золотистым цветом) и двумя шаперонами Vps75 (синий и зеленый) – белками, сопровождающими ферменты к их мишени и, частично, определяющими размер отверстия, образующегося при формировании кольца. Какая часть мишени модифицируется, определяет форма кольцевого комплекса, образующегося, когда HAT связывается с верхней частью гистонового белка. Другие шапероны могут помочь Rtt109 модифицировать другие части гистона. (Фото: Ronen Marmorstein)
Развивая эпигенетику – новую область биологии, описывающую, как экспрессия генов регулируется без изменения самой ДНК – ученые расшифровывают механизмы, с помощью которых ферменты воздействуют на окружающие ДНК белки.
Один из типов таких ферментов – белки, известные как гистон-ацетилтрансферазы (histone acetyltransferases, HATs) – оказывают воздействие на ДНК, модифицируя связанные с ней белки-гистоны. Такая модификация, называемая ацетилированием, может определять, каким образом гистоны взаимодействуют с ДНК и другими белками, оказывая влияние на такие процессы, как репликация, транскрипция и репарация. В февральском номере журнала Structure, доступном он-лайн, ученые из Института Вистара (The Wistar Institute) впервые описали полную атомную структуру гистон-ацетилтрансферазы Rtt109 дрожжей и одного из связанных с ней белков. Полученные ими данные показывают, как происходит конкретный случай ацетилирования гистона – важный шаг к пониманию эпигенетических процессов, лежащих в основе как здоровья, так и развития заболеваний.
По словам руководителя исследования Ронена Марморштайна (Ronen Marmorstein), PhD, профессора и руководителя программы Института Вистара «Экспрессия и регуляция гена», две копии Rtt109 взаимодействуют с двумя копиями белка-шаперона, образуя кольцевую структуру.
«Кольцо располагается на вершине гистона, как ореол, и мы установили, что именно тип шаперона определяет, какое влияние фермент [ацетилтрансфераза] оказывает на гистон, диктуя точное место ацетилирования», - объясняет профессор Марморштайн. «Структура представляет собой хорошую модельную систему регуляции ацетилирования белков и рассказывает нам кое-что новое о биологии этого фермента – Rtt109».
Ацетилирование добавляет ацетильную группу, маленькую химическую структуру, к лизину – одной из аминокислот, входящих в данный белок. Ацетилтрансфераза Rtt109 ацетилирует любой из трех лизинов гистона, и какой именно лизин подвергается модификации, определяется тем, какой шаперон сопровождает Rtt109 к месту реакции. Учитывая, что гистоны являются жизненно важными ассоциированными с ДНК белками, модификация одного лизина в одной из частей их структуры может оказать глубокое воздействие на «поведение» данного гистона, делая, например, доступным для считывания определенный набор генов.
В статье Марморштайн и его коллеги показывают, как Rtt109 взаимодействует с определенным шапероном – Vps75. Однако Rtt109 взаимодействует и с другим шапероном – Asf1, который, очевидно, дает возможность Rtt109 модифицировать лизин молекулы гистона в других положениях, по-другому влияя на то, как этот гистон взаимодействует с ДНК, что, в свою очередь, изменяет биологические свойства клетки.
Это исследование является первым, в котором показано, что две молекулы Rtt109 взаимодействуют с двумя молекулами шаперона Vps75, образуя кольцо. Ученые получили кристаллы белкового комплекса и, использовав метод рентгеновской кристаллографии, «увидели» его структуру на основе анализа отражения от кристалла рентгеновских лучей. Мощный источник рентгеновского излучения Advanced Photon Source Аргоннской национальной лаборатории (Argonne National Laboratory) позволил им определить структуру белкового комплекса на атомном уровне – с разрешением 2.8 ангстрем (2.8 десятимиллиардных долей метра), что меньше, чем расстояние между отдельными ступенями лестницы ДНК.

Профессор Ронен Марморштайн (Ronen Marmorstein), Ph.D., руководитель программы «Экспрессия и регуляция гена» Института Вистара. (Фото: wistar.org)
Лаборатория профессора Марморштайна начала изучение гистон-ацетилтрансфераз более десяти лет назад, и несколько крупномасштабных исследований показали, что ацетилирование свойственно более чем 2000 белков, при этом не только гистонам. По мнению Марморштайна, существует целая сеть взаимодействий, непосредственно связанная с ацетилированием белков – еще один уровень сложности в и без того сложной области.
«Мы увидели, что многие различные белки, входящие в несколько различных путей, подвергаются ацетилированию, что оказывает влияние на процессы метаболизма РНК, контроль над клеточным циклом, развитие рака и целый ряд других биологических аспектов. По-видимому, ацетилирование белков имеет гораздо более широкое биологическое значение, чем представлялось ранее», - считает профессор Марморштайн. «Во многом это похоже на то, что мы увидели за последние годы при изучении протеинкиназ и клеточного сигналинга. Мы узнали, что гистон-ацетилтрансферазы и, возможно, ацетилтрансферазы других белков регулируются аналогичным образом. Они оказывают на клетку очень глубокое воздействие, но это - совсем новая область науки. Как все это работает – большой черный ящик, который мы намерены открыть».
По материалам
How the hat fits: Structural biology study reveals shape of epigenetic enzyme complex
Оригинальная статья:
Yong Tang, Marc A. Holbert, Neda Delgoshaie, Hugo Wurtele, Benoît Guillemette, Katrina Meeth, Hua Yuan, Paul Drogaris, Eun-Hye Lee, Chantal Durette, Pierre Thibault, Alain Verreault, Philip A. Cole, Ronen Marmorstein. Structure of the Rtt109-AcCoA/Vps75 Complex and Implications for Chaperone-Mediated Histone Acetylation
© «Как шляпка сидит? Структурная биология изучает процесс ацетилирования». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Вглубь живой материи.
Related Articles: |













