|
Ключевым вопросом в биохимии белков является то, каким образом белки узнают «правильных» партнеров для взаимодействия в море клеточных факторов. Нигде больше это не важно в такой степени, как в мозге, где взаимодействия, управляющие активностью белковых каналов, могут изменять поведение организма. Группа биологов из Института биологических исследований Солка (Salk Institute for Biological Studies) недавно расшифровала молекулярный код, регулирующий доступность канала мозга, модулирующего возбудимость нейронов – открытие, которое может помочь в разработке методов лечения наркомании, алкоголизма и психических расстройств.
В журнале Proceedings of the National Academy of Sciences адъюнкт-профессор Лаборатории биологии пептидов Фонда Клейтона (Clayton Foundation Laboratories for Peptide Biology) доктор философии Пол Слесингер (Paul Slesinger) и его коллеги установили, как регуляторный фактор SNX27 отличает белок канала GIRK (G-protein-coupled inwardly rectifying potassium channel) от структурно аналогичных белков и делает его мишенью для разрушения.
Эта работа является продолжением исследования, проведенного группой в 2007 году, которое показало, что белок SNX27 захватывает каналы GIRK, уменьшая их количество в клеточных мембранах. «Нам было интересно, что определяет избирательность этого взаимодействия», - говорит Слесингер. «Мы знали, что SNX27 взаимодействует со структурным мотивом, найденным в каналах GIRK, но такой мотив демонстрируют многие аналогичные каналы. Мы хотели узнать, что позволяет SNX27 специфически выбирать каналы GIRK».
Знать, на чем основана такая избирательность, очень важно для понимания взаимодействия каналов GIRK с психоактивными веществами. Слесингер и его коллеги показали, что алкоголь и клубные наркотики оказывают влияние именно на функцию каналов GIRK в мозге. Поведение, для которого характерна потеря торможения, ассоциируемое с употреблением этих веществ, объясняется тем, что каналы GIRK позволяют ионам калия просачиваться из активированного нейрона, снижая, тем самым, возбудимость клетки.
В своем новом исследовании группа Слесингера подтвердила, что в нейронах белок SNX27 находится непосредственно под мембраной, где расположены и активные каналы GIRK. Дополнительные эксперименты с использованием клеток мозга, экспрессирующих аномально высокие уровни SNX27, показали, что такие клетки менее чувствительны к препаратам, активирующим каналы, предполагая, что белок SNX27 «подстерегает» связанные с мембраной GIRKs и блокирует их функцию.
Тот факт, что SNX27 демонстрирует обычную сигнатуру белкового взаимодействия, называемую PDZ-доменом, дает возможность предположить, каким образом SNX27 связывает своего партнера: каналы GIRK содержат короткую, из четырех остатков, последовательность, связывающуюся с PDZ-доменом – мотив узнавания, сравниваемый Слесингером с почтовым индексом. Но каналы IRK, аналогичные GIRK, имеют практически идентичные последовательности. Тем не менее, они не подвержены разрушению белком SNX27. «Мы были озадачены таким сходством и заменили 4-остатовный код в IRK соответствующей последовательностью из GIRK», - говорит Слесингер. К удивлению ученых, полученный IRK/GIRK-гибрид не связывал SNX27, указывая на то, что в IRK не было других элементов, необходимых для узнавания SNX27.
Чтобы определить эти новые элементы, Слесингер проконсультировался со своим давним коллегой профессором лаборатории структурной биологии Института Солка Сеньон Чвэ (Senyon Choe). Профессор Чвэ - специалист в области рентгеновской кристаллографии, используемой для определения трехмерной структуры белков. Чтобы визуализировать, где происходит контакт белков, ученые тщательно изучили кристаллическую структуру SNX27, взаимодействующего со связующим мотивом GIRK.
«Мы наблюдали связующий карман в PDZ-домене SNX27 и область, которая образовывала еще один карман с большим количеством положительных зарядов», - говори Слесингер. «Находящийся там фрагмент GIRK имел отрицательный заряд выше 4-остаточного «почтового индекса». Это предполагало, что этот второй сайт позволял ранее неизвестное электростатическое взаимодействие между этими двумя белками». Поэтому SNX27 может узнавать 6-остаточный мотив как «почтовый индекс 4+».
Дополнительные эксперименты с заменой негативно заряженной области-мишени GIRK подтвердили эту гипотезу. Синтетические формы GIRK, не имеющие этой области, не связываются SNX27. И наоборот, искусственная версия IRK, содержащая отрицательные заряды GIRK, взаимодействует с SNX27.
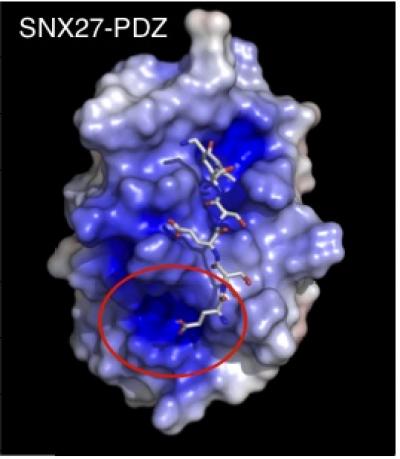
3D-структура PDZ-домена белка SNX27, связанного с С-терминальным хвостом канала GIRK. Наложено условное изображение электрического потенциала (синий цвет соответствует положительным зарядам) PDZ-домена SNX27 и узнаваемого им шестиаминокислотного «штрих-кода». Красный круг показывает вновь выявленный второй карман и отрицательно заряженные остатки канала GIRK. (Изображение: Courtesy of Bartosz Balana and Paul Slesinger)
Особое значение имели эксперименты, проведенные Бартошом Балана (Bartosz Balana), постдокторантом лаборатории Слесингера и первым автором статьи. Балана измерил токи клеток с инженерными каналами GIRK, не имеющими заряженной области, и установил, что белок SNX27 больше не снижал клеточные токи, в то время как клетки, экспрессирующие каналы IRK с ложным GIRK-«штрих кодом» отвечали на SNX27.
«Функциональный анализ выявил остатки, обеспечивающие связывание SNX27 вне обычного PDZ-домена», - объясняет Бартош. «Это поддерживает концепцию модели с двумя связующими сайтами и подчеркивает, что второй сайт может отменить связывание по классическому сайту».
Интересным следствием участия каналов GIRK в биохимии наркотической зависимости является то, что у грызунов с привыканием к стимуляторам типа кокаина и метамфетамина уровни SNX27 повышены. Избирательное блокирование вновь открытого взаимодействия между GIRK и SNX27 может прервать эту зависимость. Теперь ученые смогут лучше понять роль этих каналов в реакции организма на наркотики. Слесингер и его коллеги надеются, что их работа приведет к выработке новых стратегий в лечении таких болезней, как алкоголизм, и, возможно, эпилепсия.
По материалам
Salk scientists crack molecular code regulating neuronal excitability
Аннотация к статье Mechanism underlying selective regulation of G protein-gated inwardly rectifying potassium channels by the psychostimulant-sensitive sorting nexin 27

Related Articles: |













