|
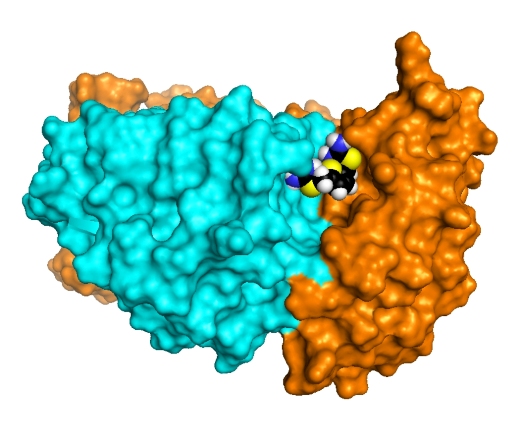
Американские ученые идентифицировали новый класс соединений – фармакологические шапероны, – способный стабилизировать белковый комплекс ретромер (бирюзово-оранжевая структура на рисунке представляет часть этого комплекса). Ретромер играет жизненно важную роль в предотвращении расщепления белка-предшественника амилоида и образовании токсичного побочного продукта бета-амилоида, вносящего вклад в развитие болезни Альцгеймера. Исследование показало, что добавленный к культуре нейронов шаперон R55 (показан как разноцветная молекула) связывает и стабилизирует ретромер, повышая его уровни и снижая уровни бета-амилоида. (Рис. Nature Chemical Biology and lab of Scott A. Small, MD/Columbia University Medical Center)
Группа ученых из Медицинского центра Колумбийского университета (Columbia University Medical Center, CUMC), Медицинского колледжа Вейлла Корнеллского университета (Weill Cornell Medical College) и Университета Брэндейса (Brandeis University) разработала совершенно новый подход к лечению болезни Альцгеймера, основанный на воздействии на ретромер. Ретромер играет жизненно важную роль в нейронах, удерживая белок-предшественник амилоида (amyloid precursor protein, APP) вдали от той области клетки, где он расщепляется, образуя потенциально токсичный побочный продукт бета-амилоид, способствующий, как считается, развитию болезни Альцгеймера.
С помощью виртуального компьютерного скрининга исследователи идентифицировали новый класс соединений под названием фармакологические шапероны, значительно повышающих уровни ретромера и снижающих уровни бета-амилоида в культуре нейронов гиппокампа без видимой токсичности для клеток. Статья о результатах исследования опубликована в онлайн-издании журнала Nature Chemical Biology.
Доктор Пецко и его коллеги изучают еще не изведанные пути в биологии болезни Альцгеймера, в частности, какую роль могут играть в развитии этого нейродегенеративного заболевания нарушения в сортировке белков. Их внимание сосредоточено на белковом комплексе, называемом ретромером, который Пецко сравнивает с водителем грузовика, потому что его работа состоит в том, чтобы сортировать и отвозить белки либо в аппарат Гольджи – рециклинговый центр клетки, – либо к лизосомам для разрезания. Что касается непосредственно болезни Альцгеймера, идея исследователей заключается в том, что в основе накопления бета-амилоида – белка, считающегося ключевым игроком в развитии этого заболевания, – может лежать неправильная сортировка белка (cenblog.org). На рисунке роль ретромера в развитии болезни Альцгеймера. (Рис. G. Petsko)
Аналогия с грузовиком. (Рис. G. Petsko)
«Мы идентифицировали новый класс фармакологических агентов, предназначенных для лечения неврологических заболеваний путем таргетинга дефекта скорее клеточной, чем молекулярной биологии», - говорит руководитель исследования профессор неврологии Скотт Смолл (Scott Small), MD, директор Исследовательского центра болезни Альцгеймера (Alzheimer's Disease Research Center) Исследовательского института болезни Альцгеймера и старения мозга Тауба (Taub Institute for Research on Alzheimer's Disease and the Aging Brain) CUMC. «Этот подход может оказаться более безопасным и эффективным, чем традиционные методы лечения неврологических заболеваний, мишенями которых обычно являются отдельные белки».
В 2005 году профессор Смолл и его коллеги показали, что в мозге пациентов с болезнью Альцгеймера наблюдается дефицит ретромера. На культуре нейронов они продемонстрировали, что снижение уровней ретромера повышает уровни бета-амилоида, в то время как повышение уровней ретромера производит противоположный эффект. Три года спустя исследователи показали, что снижение уровней ретромера оказывает такой же эффект на животных моделях, и что эти изменения вызывают симптомы, близкие к симптомам болезни Альцгеймера. Связанные с ретромером аномалии наблюдаются и при болезни Паркинсона.
Профессора Смолла и его коллег заинтересовало, можно ли стабилизировать ретромер (то есть предотвратить его разрушение) и повысить его активность.
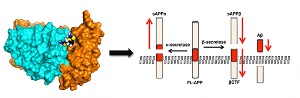
На пути от клеточной мембраны к другим клеточным процессинговым компартментам белок-предшественник амилоида (APP) делает остановку в эндосоме. Оттуда ретромер перемещает APP к транс-Гольджи сети или назад к поверхности клетки. Однако, если функция ретромера нарушена, белок-предшественник амилоида задерживается в эндосомах, где он находится во власти фермента BACE1. Ранее группа профессора Смолла уже показала, что дисфункция ретромера приводит к повышению уровня бета-амилоида в культивируемых нейронах. Другими учеными установлено, что варианты связанных с ретромером генов повышают риск развития болезни Альцгеймера. С другой стороны, предыдущие исследования показали, что увеличение в клетке количества ретмомера повышает ее способность к трафику белков. Основываясь на этой идее, группа профессора Смолла полагает, что стабилизация ретромера может защитить его от деградации, увеличить его количество в клетке и помочь в удалении APP из эндосомы. На рисунке R55 находится между субъединицами ретромера (бирюзово-оранжевого комплекса), укрепляя их связь, снижая β- и повышая α-секретазное расщепление белка-предшественника амилоида. (Рис. Mecozzi et al., Nature Chemical Biology)
«Идея о том, что защита структуры того или иного белка может принести пользу, относится к идеям, к которым природа пришла давным-давно», - говорит о цели работы ее соавтор Грегори Пецко (Gregory Petsko), PhD. «Мы же просто хотим узнать, как сделать это фармакологически».
Ученым уже известна трехмерная структуру ретромера.
«Наша задача состояла в том, чтобы найти малые молекулы, или фармакологические шапероны, которые могли бы связаться со слабым местом ретромера и стабилизировать весь белковый комплекс», - говорит другой соавтор работы Дагмар Ринге (Dagmar Ringe), PhD.
Это было достигнуто с помощью компьютеризированного виртуального, или in silico, скрининга известных химических соединений, имитирующего, как эти соединения могли бы состыковываться с белковым комплексом ретромера. (При обычном скрининге соединения физически тестируются на взаимодействие с нужной мишенью – более дорогой и более длительный процесс.) Скрининг выявил 100 потенциальных кандидатов, способных стабилизировать ретромер, 24 из которых показали себя особенно перспективными. Из них одно соединение – R55 – значительно повышало стабильность ретромера в условиях теплового стресса.
Затем исследователи изучили, какое влияние R55 оказывает на нейроны гиппокампа – ключевой структуры мозга, участвующей в процессах обучения и памяти.
«Мы опасались, что это соединение может оказаться токсичным», - поясняет ведущий автор исследования доктор Диего Берман (Diego Berman), доцент кафедры клинической патологии и клеточной биологии в CUMC. «Но, как было установлено на культуре мышиных нейронов, R55 относительно нетоксичен».
Соединение R55 значительно повысило уровни ретромера и снизило уровни бета-амилоида в культуре нейронов здоровых мышей и мышей с моделью болезни Альцгеймера. В настоящее время исследователи тестируют клинические эффекты R55 на живых животных с моделью этого заболевания.
«Шансы, что успех принесет именно это соединение, низки, но наша статья представляет доказательства состоятельности самой концепции – эффективности фармакологических шаперонов ретромера», - заключает доктор Пецко. «Параллельно с тестированием R55 мы будем разрабатывать его химические аналоги в надежде найти более эффективные соединения».
По материалам
“Chaperone” Compounds Offer New Approach to Alzheimer’s Treatment
Оригинальная статья:
Vincent J Mecozzi, Diego E Berman, Sabrina Simoes, Chris Vetanovetz, Mehraj R Awal, Vivek M Patel, Remy T Schneider, Gregory A Petsko, Dagmar Ringe, Scott A Small. Pharmacological chaperones stabilize retromer to limit APP processing
© «Соединения-«шапероны» предлагают новый подход к лечению болезни Альцгеймера». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Болезнь Альцгеймера.
Related Articles: |













