|
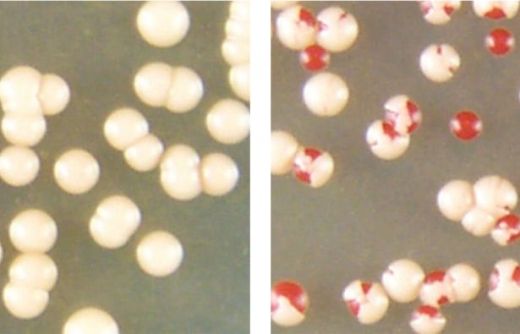
Когда колонии дрожжевых клеток, содержащих скопления прионных белков (колонии белых клеток слева), оказываются в стрессовых условиях (подвергаются воздействию высоких температур), некоторые из них могут трансформировать эти агрегированные белки в неслипающуюся форму (красные клетки в колониях справа). (Фото: Serio laboratory/University of Arizona molecular and cellular biology)
Согласно новому исследованию, проведенному учеными Университета Аризоны (University of Arizona, UA), клетки дрожжей иногда могут повернуть вспять процесс неправильного фолдинга белков и образования их скоплений, связанный с нейродегенеративными заболеваниями. Этот вывод противоречит идее о том, что, если прионные белки трансформировались в форму, способную к агрегации, это изменение необратимо.
«Считается, что, если такие агрегаты образовались, клетки уже не могут от них избавиться», - говорит Триша Серио (Tricia Serio), профессор и заведующий кафедрой молекулярной и клеточной биологии UA. «Мы показали, что это не так. Клетки могут очиститься от этих агрегатов».
Прионы – белки, обладающие свойством трансформироваться в форму, являющуюся триггером изменения формы их соседей. В этой новой форме белки образуют кластеры. Агрегаты, называемые амилоидами, связаны со многим заболеваниями, включая болезни Альцгеймера, Хантингтона и Паркинсона.
«Прионный белок – своего рода доктор Джекил и мистер Хайд», - продолжает профессор Серио, руководитель исследования, опубликованного в журнале с открытым доступом eLife. «Если уж Хайд образовался, все прионные белки, образовавшиеся позднее, сворачиваются этим порочным образом».
Для дрожжей присутствие скоплений амилоида не является фатальным. Профессор Серио и ее ученики нагревали содержащие амилоид клетки пекарских дрожжей (до 40° C) – температуры, очень высокой по меркам человеческого организма. Находясь в такой среде, клетки отвечали стрессовой реакцией, которая изменяла форму белков из слипающейся в неслипающуюся.
Это открытие предполагает, что в перспективе искусственная индукция ответной реакции на стресс может помочь в разработке методов лечения заболеваний, связанных с неправильно свернутыми прионными белками, считает Серио.
«Попытки разработать терапевтические средства, искусственно вызывающие реакции на стресс, уже делаются», - продолжает она. «Наша работа служит доказательством принципа, что это плодотворный путь, по которому нужно следовать и дальше».
Для выполнения своих функций внутри клеток белок должен принять определенную форму. В клетках есть механизмы «контроля над качеством», которые обычно предотвращают его неправильное свертывание. Однако при определенных стрессовых условиях эти механизмы сами выходят из строя, и белки все же свертываются неправильно, иногда образуя амилоиды.
Клетки реагируют на стресс синтезом специфических белков, известных как белки теплового шока (heat-shock proteins), которые, как известно, помогают предотвратить мисфолдинг белков.
Профессор Серио и ее студенты решили узнать, могут ли те или иные белки теплового шока вернуть амилоиды к нормальной форме. Для этого исследователи изучили дрожжевые клетки, которые, как считается, не могут очиститься от амилоидной формы прионного белка Sup35.
Чтобы выяснить, какие именно белки необходимы для устранения амилоидов, исследователи поочередно тестировали разные белки теплового шока. Однако эти эксперименты не дали практически никакого результата. Поэтому они решили ввести дрожжевые клетки в состояние стресса воздействием на них повышенной температурой (40° С) и дать клеткам возможность делать то, что происходит естественным образом.
В результате клетки синтезировали целый ряд белков теплового шока, и исследователи установили, что на одной из стадий репродуктивного цикла дрожжи могут превращать агрегаты Sup35 в неслипающуюся форму этого белка.
Клетки дрожжей размножаются почкованием. Материнская клетка отделяет небольшую часть самой себя, образуя гораздо меньшую по размерам дочернюю клетку, связанную с ней перетяжкой. Перетяжка постепенно сужается, и молодая клетка отделяется от материнской, а затем растет.
Исследователи установили, что у находящихся в стрессовом состоянии дрожжей в период образования дочерней клетки большинство белков теплового шока, называемых шаперонами, в частности, HSP-104, остаются в материнской клетке. В результате в материнской клетке наблюдается особенно высокая концентрация HSP-104, так как она поделилась им с дочерней клеткой лишь в незначительной степени.
Материнские клетки в конечном итоге «излечили» себя от амилоида Sup35, чего не сделали дочерние. Степень «излечения» коррелировала с концентрацией в клетках HSP-104, и чем выше была температура, тем больше в них было HSP-104.
HSP-104 берет белок амилоида и изменяет его форму, комментирует Серио. Но само по себе индуцирование высоких уровней HSP-104 не трансформирует амилоидный белок в неслипающуюся форму.
«Очевидно, белки теплового шока каким-то образом взаимодействуют друг другом, но как они это делают, мы не понимаем», - признает профессор Серио.
Присутствие амилоид-образующей версии белка не является абсолютным злом. Вполне возможно, что эта форма нужна в одних условиях среды, а неагрегирующая форма – в других. Даже у людей амилоидные формы белка могут быть полезными, уточняет Серио. В частности, амилоидные белки связаны с пигментацией кожи.
Чтобы очистить дрожжевые клетки от амилоида, исследователи заставляли их синтезировать множество различных белков теплового шока. Теперь профессор Серио хочет выяснить, какова необходимая для этого минимальная система. Эти знания могут помочь в разработке лекарственной терапии связанных с амилоидами человеческих заболеваний.
По материалам
Yeast Are First Cells Known to Cure Themselves of Prions
Оригинальная статья:
Courtney L Klaips, Megan L Hochstrasser, Christine R Langlois, Tricia R Serio. Spatial quality control bypasses cell-based limitations on proteostasis to promote prion curing
© «Клетки дрожжей способны избавляться от прионных белков». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Нейродегенеративные заболевания. Письменное разрешение обязательно.
Related Articles: |













