|
Ученые Принстонского университета (Princeton University) установили молекулярный механизм метастазирования рака молочной железы в кости – открытие, которое может привести к новым методам лечения этого заболевания.
Распространяясь по организму пациентов с прогрессирующим раком молочной железы, раковые клетки часто образуют новые опухоли – процесс, называемый метастазированием, – обычно вызывая злокачественные новообразования костей. Принстонские ученые установили точный механизм, позволяющий мигрирующим опухолевым клеткам нарушать нормальный рост костной ткани. Блокировав принимающие участие в этом процессе молекулы, в частности, белок Jagged1, посылающий клеткам деструктивные сигналы, исследователи открыли дверь лекарственной терапии, способной остановить этот разрушительный процесс. Ознакомившиеся с исследованием врачи других медицинских центров нашли его результаты перспективными.

Адъюнкт-профессор молекулярной биологии Принстонского университета Ибинь Кан (Yibin Kang) установил точный молекулярный механизм метастазирования рака груди в кости. (Photo by Brian Wilson)
«Сейчас у нас немного методов лечения, которые мы могли бы предложить таким пациентам», - говорит Ибинь Кан (Yibin Kang), адъюнкт-профессор молекулярной биологии Принстона, возглавлявший исследовательскую группу. «Врачи могут воздействовать на симптомы такого рака костей, но не более. Наше открытие показывает, что может существовать новый способ лечения», способный замедлить или остановить развитие костных опухолей.
Рак молочной железы метастазирует в кости у 70-80 процентов пациентом с поздними стадиями опухолевого процесса, приводя также к новообразованиям в головном мозге, легких и печени. Кроме того, метастатический рак костей является частым случаем среди больных с поздними стадиями рака простаты, легких и кожи. В исследовании, опубликованном в журнале Cancer Cell, ученые показали, что клетки рака груди способны посылать клеткам кости неверные инструкции (процесс, известный как сигналинг) с катастрофическими последствиями для пациента.
Чтобы создавать и восстанавливать ткани и эффективно поддерживать нормальные физиологические функции, миллиарды клеток живого человеческого организма должны общаться друг с другом. Клеточный сигналинг является частью сложной системы, которая позволяет им это делать, но у пациентов с раком связь между сигнальными молекулами и молекулами, которые взаимодействуют с ними, грубо нарушена.
Сигнальные молекулы могут быть получены и прочитаны клеткой посредством рецепторов, находящихся на ее поверхности. После связывания сигнальной молекулы с рецептором их союз запускает процесс, который приводит к изменению поведения данной клетки. Последовательность дальнейших событий определяется сигнальным путем, представляющим собой группу совместно функционирующих молекул, в которой одна молекула активирует следующую до тех пор, пока не выполнена специфическая функция, например, обновление клеток органа. Существует очень много таких сигнальных путей.
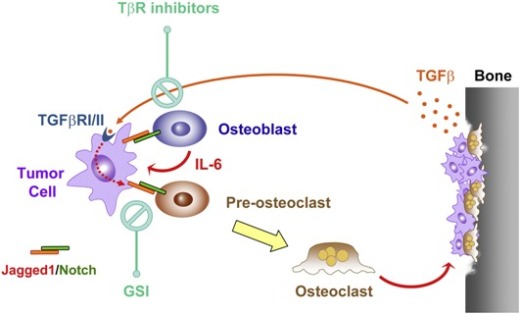
Но в случае метастатического рака молочной железы формируется разрушительный сигнальный путь. Сигнальная молекула, называемая лигандом, связывается с молекулой-рецептором на определенных клетках кости и активирует клеточный путь, который в конечном итоге нарушает процесс ее нормального обновления. Кан и его коллеги идентифицировали эту сигнальную молекулу как Jagged1, а молекулу-рецептор как способную активировать клеточный путь Notch.
Это дает исследователям рака специфическую мишень, предполагающую возможность разработки путей нейтрализации разрушительной силы белка Jagged1 и предотвращения его вмешательства в процесс нормального роста кости.
Жаклин Бромберг (Jacqueline Bromberg), врач нью-йоркского онкологического центра Memorial Sloan-Kettering Cancer Center, также изучающая рак груди, считает открытие группы Кана многообещающим.
«Кость является наиболее частой областью метастазирования при раке молочной железы», - говорит Бромберг. Хотя существуют методы лечения, способные затормозить развитие этих опухолей, такие как блокаторы эстрогена, облучение и химиотерапия, «в нашем распоряжении мало методов, способных эффективно уничтожать костные метастазы».
Тереза Гиз (Theresa Guise) из Школы медицины Университета Индианы (University of Indiana) в Индианаполисе считает, что открытие принстонских ученых «показывает важнейшие взаимодействия между опухолевыми клетками и клетками кости». По ее мнению, группа значительно углубила понимание вопроса, «проанализировав вклад в процесс как самой опухоли, так и ее микроокружения».

Ибинь Кан (Yibin Kang) и Нилей Сети (Nilay Sethi) (слева). (Photo by Brian Wilson)
Исследование основывается на более ранней работе, начатой лабораторией Кана шесть лет назад, в которой ученые рассматривали вопрос о том, каким образом распространению рака в кости способствуют несколько различных сигнальных путей. В работе, опубликованной в журнале Nature Medicine в 2009 году, Кан показал, что определенную роль в росте опухолей костей играет путь, известный как TGF-beta (Transforming growth factor beta). Но до последнего исследования не было ясно, что решающую роль в этом процессе играет Jagged1. До настоящей работы, сфокусированной на идентификации серии взаимосвязанных событий, создающих сеть разрушительных путей, Кан и Нилей Сети (Nilay Sethi), молекулярный биолог из Принстона, искали, какие из сигнальных молекул были активны у пациентов с раком груди, метастазировавшим в кости.
«Оказалось, что во взятых у пациентов с распространившимся на кости раком груди образцах опухолевой ткани присутствовали высокие уровни Jagged1», - говорит Сети.
Настоящее исследование показывает, что взаимодействие сигнальной молекулы Jagged1 со своим рецептором на остеобластах включает сигнальный путь Notch, что приводит к драматическим изменениям в процессе их роста. «Это словно ключ, нашедший соответствующий ему замок, открывающий шлюз для потока информации», - говорит Кан. «К несчастью, в этом случае, Jagged1-Notch-сигналинг используется раковыми клетками в разрушительных целях».
В здоровой кости специализированные костные клетки, называемые остеокластами, «чистят» поверхность кости, используя для этого сочетание ферментов и кислот, разрушающих старую ткань. Затем другая группа костных клеток - остеобласты – образовывает новый слой костного матрикса для восстановления костной ткани. Синхронная работа клеточных «экскаваторов» и «дорожных укладчиков», очищающих кость скребков-остеокластов и строителей-остеобластов, постоянно обновляет кость и сохраняет ее прочность. Нарушение баланса активности этих клеток приводит к заболеваниям.
Хотя опухолевые клетки не обладают специальными инструментами, которые есть у остеокластов, чтобы нарушить сбалансированный процесс обновления кости, они способны использовать разрушительную молекулу Jagged1, заставляя остеокласты и остеобласты вести себя таким образом, который позволяет опухолевым клеткам вторгнуться в кость.
Например, активировав Notch-сигналинг в остеокластах, Jagged1 заставляет предшественников остеокластов, известных как моноциты, быстрее трансформироваться в зрелые клетки. Массивное накопление разрушающих кость остеокластов становится первым шагом к успеху инвазивной атаки опухолевых клеток. Это ускоряет разрушение костной ткани и открывает путь к формированию опухолевыми клетками злокачественных масс.
«Одновременно Jagged1 посылает инструкции остеобластам секретировать повышенные уровни интерлейкина-6 (Interleukin-6), фактора роста опухолей, и рак, таким образом, растет еще быстрее», - объясняет Кан. «Это двойной удар».
Приводя к дальнейшему ухудшению состояния, разрушение костного матрикса вызывает высвобождение больших количеств другого белка – TGF-beta – еще одной сигнальной молекулы, включенной в костный матрикс во время процесса формирования кости. В своей более ранней работе, опубликованной в 2009 году, Кан и его коллеги показали, что белок TGF-beta, полученный из костей, обеспечивает энергией злокачественный рост костных метастазов.
В некоторых экспериментах текущего исследования, проведенных Сети, была установлена удивительная неизвестная ранее связь между TGF-beta и молекулой Jagged1 в костных метастазах.
«Когда опухолевые клетки используют остеокласты для разрушения кости и высвобождения TGF-beta, белок посылает опухолевым клеткам обратный сигнал, стимулирующий в них экспрессию Jagged1», - объясняет Сети. «Взаимодействие между сигнальными путями Jagged1/Notch и TGF-beta создает порочный круг, вызывающий по существу неостановимый рост опухоли и разрушение скелетных тканей».
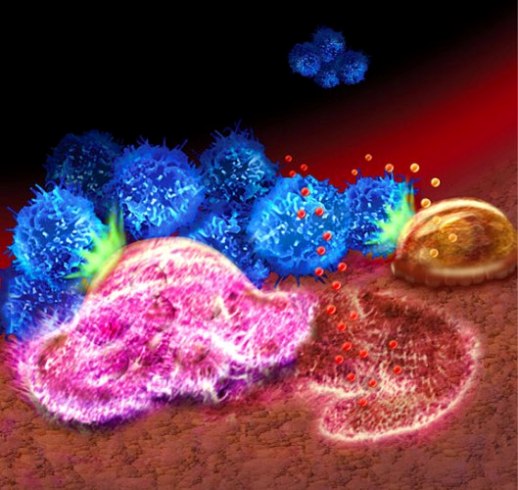
Метастазирование рака молочной железы в кости обусловлено взаимодействием опухолевых клеток (синие), специализированных клеток, разрушающих кость – остеокластов (розовые), специализированных клеток, восстанавливающих костную ткань – остеобластов (коричневые) и костного матрикса. Сигнальный белок Jagged1 посылает деструктивные инструкции, активирующие группу взаимодействующих молекул, образующих сигнальный путь Notch (зеленая вспышка) в клетках кости. Notch-сигналинг стимулирует разрушающую кость активность остеокластов, высвобождая факторы роста опухолей, такие как белок TGF-beta (красные пузырьки), из костного матрикса. Между тем Notch-сигналинг в восстанавливающих кость остеобластах усиливает экспрессию другого секретируемого белка, интерлейкина-6 (IL-6) (оранжевые пузырьки), который отправляет обратный сигнал опухолевым клеткам, способствуя их росту, что приводит к образованию порочного круга и дальнейшему метастазированию. (Credit: Illustration by Stephen Cheng)
Сети, не только молекулярный биолог, но и медик, остро осознает последствия костных метастазов. «Такие пациенты очень страдают. У них частые переломы, сильные боли в костях и изнурительная компрессия нервов», - говорит он. Кроме того, при разрушении костей кальций накапливается в крови, вызывая другие угрожающие жизни осложнения.
Ключом к остановке процесса, как представляется, является поиск пути нейтрализации сигнальной молекулы Jagged1 или ее рецептора Notch.
У Кана есть несколько идей о том, как это сделать. Одним из способов прервать разрушительный процесс является поставить препятствие на пути Notch. Этого можно достичь, заблокировав активность гамма-секретазы – фермента, играющего роль в активации пути Notch - так как без нее не может быть завершена доставка инструкций костным клеткам. Фармацевтическая фирма Merck & Co разработала такой экспериментальный блокирующий гамма-секретазу препарат, известный как ингибитор гамма-секретазы, или GSI (gamma secretase inhibitor), и обеспечила им лабораторию Кана для поддержки работы ученых.
Препарат уже зарекомендовал себя в качестве перспективного средства лечения метастатического рака костей. В экспериментах на животных доказано, что эти ингибиторы блокируют вызывающий заболевание сигналинг между клетками опухоли и клетками кости, то есть взаимодействие, опосредованное белком Jagged1 и Notch. GSI может значительно снизить метастазирование в кости наряду с сокращением их разрушения.
Кан надеется, что полученные его группой новые данные, показывающие, что ингибиторы гамма-секретазы останавливают распространение рака на кости, будут способствовать проведению клинических испытаний GSI в ближайшем будущем.
(sciencedirect.com)
По словам Кана, в настоящее время существует мало препаратов, способных облегчить симптомы, связанные с костными метастазами, и нет ни одного, способного полностью остановить рак. Если его открытия приведут к созданию препарата, который может остановить или замедлить этот процесс, это окажет положительное влияние на жизнь 200000 пациентов, у которых каждый год, по оценкам Национального института рака США (National Cancer Institute), диагностируется рак молочной железы. Такой препарат мог бы помочь многим пациентам, страдающим и другими видами рака.
Как отмечает Жаклин Бромберг, недавнее открытие Кана «подчеркивает особую важность ориентации на условия микросреды, в которой развивается болезнь, в данном случае на активность сигнального пути Notch и специфические взаимодействия между раковыми и специализированными клетками, разрушающими и восстанавливающими кость».
По материалам
Scientists discover mechanism involved in breast cancer's spread to bone
Аннотация к статье Tumor-Derived Jagged1 Promotes Osteolytic Bone Metastasis of Breast Cancer by Engaging Notch Signaling in Bone Cells

Related Articles: |













