|
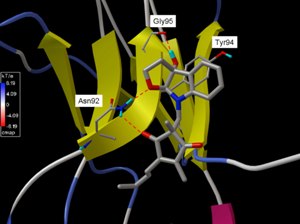
Модель, созданная доктором философии Ченлонг Ли в Суперкомпьютерном центре Огайо, иллюстрирует связывание молекулы MDL-A (шаростержневая) с фрагментом рецептора GP130 (желтая лента). Ли применяет основанную на фрагментах разработку лекарственных препаратов для блокирования Интерлейкина-6, небольшой белковой молекулы, играющей определенную роль в развитии рака молочной железы и простаты. (Фото: Chenglong Li/OSU)
Чтобы найти среди тысяч молекулярных комбинаций лучшую конфигурацию для блокирования белка, который, вероятно, способен вызывать рак молочной железы и простаты, биофизик из Университета штата Огайо (Ohio State University, OSU) использовал суперкомпьютер.
Для разработки лекарственного препарата, способного блокировать молекулу белка Интерлейкина-6 (IL-6) доктор философии Ченлонг Ли (Chenglong Li), доцент кафедры медицинской химии и фармакологии Университета штата Огайо (Ohio State University, OSU), использует мощный компьютерный кластер Суперкомпьютерного центра Огайо (Supercomputer Center, OSC). Интерлейкин-6 – иммунные молекулы-мессенджеры – обычно вырабатываются организмом для борьбы с инфекциями, ожогами, ранами и т.д. Однако ученые установили, что организму больных раком не удается отключить иммунный ответ, что в результате приводит к гиперпродукции IL-6.

Доцент кафедры медицинской химии и фармакологии Университета штата Огайо доктор философии Ченлонг Ли (Chenglong Li). (Фото: osc.edu)
Между воспалением и раком существует теснейшая связь. В случае рака молочной железы медицинские обзоры систематически отмечали повышение уровней IL-6 у различных категорий больных. Уровни Интерлейкина-6 были повышены до 40 раз, особенно на поздних стадиях, при метастазировании и рецидивах заболевания.
В 2002 году японские ученые обнаружили, что природная нетоксичная молекула, синтезируемая в организме морских бактерий – madindoline A (MDL-A) – может быть использована для мягкого подавления сигнала IL-6. К сожалению, молекула не могла достаточно сильно связывать IL-6, чтобы стать эффективным противораковым препаратом, а синтезировать ее на коммерческой основе было бы слишком сложно и дорого. И, что самое удивительное, ученые столкнулись с тем, что бактерии быстро мутировали и начинали вырабатывать другое, совершенно неэффективное соединение. Примерно в то же время ученым Стэнфордского университета (Stanford University) удалось получить статичное изображение кристаллической структуры Интерлейкина-6 и двух взаимодействующих с ним белков.
Понимая потенциал этих технологий, Ли начал сотрудничество с химиком-органиком и биологом, занимающимся изучением рака, из Онкологической больницы Джеймса (James Cancer Hospital) OSU, чтобы, используя суперкомпьютер OSC, построить гибкие трехмерные цветные модели этого белкового комплекса для более глубокого его изучения.
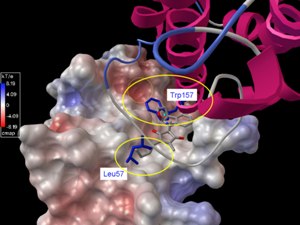
Электростатическая репрезентация (красный цвет – отрицательные, синий – положительные, белый – гидрофобные зоны), созданная в Суперкомпьютерном центре Огайо доктором Ченлонг Ли, показывает Интерлейкин-6 в виде ленты. Два больших желтых эллипса отмечают две связующие «горячие точки» между Интерлейкином-6 и рецептором GP130 – ключи к блокированию белка, играющего определенную роль в развитии рака груди и предстательной железы. (Фото: Chenglong Li/OSU)
«Чтобы разработать новый набор химических соединений, которые не только сохраняли бы первоначальные свойства, но были бы более мощными и эффективными, мы решили использовать компьютерный интеллект», - говорит Ли. «Наши начальные технологические изыскания указали на соединения, на основе которых с высокой долей вероятности можно получить нетоксичный, принимаемый внутрь лекарственный препарат».
Используя мощности кластера Glenn IBM 1350 Opteron, Ли создал модель Интерлейкина-6 и двух вспомогательных белков, необходимых для передачи сигнала: рецептора IL-6 и сигнал-трансдуцирующего рецептора GP130. Объединение двух полных наборов этих трех белков приводит к образованию состоящей из шести субъединиц молекулярной машины, или гексамера, передающей сигналы, которые, впоследствии, вызовут клеточное воспаление и, возможно, рак.
Чтобы охарактеризовать взаимодействия между этими белками и определить силу их связывания в пяти «горячих точках», находящихся в каждой половине гексамера IL-6/IL-6R/GP130, Ли использовал программное обеспечение для молекулярного моделирования AMBER (Assisted Model Building with Energy Refinement) и AutoDock.
При «подключении» малых молекул, таких как MDL-A, к этим горячим точкам, Ли мог блокировать образование гексамера. Он проанализировал силу связывания MDL-A с каждой горячей точкой гексамера и определил наиболее перспективную связь – между IL-6 и первым сегментом, или модульным доменом (D1), рецептора GP130.
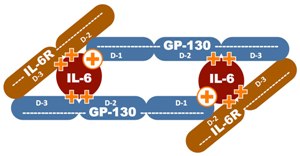
Графическое изображение результатов исследования, проведенного доктором философии Ченлонг Ли, иллюстрирует составляющие гексамер три белка, два набора «горячих точек» (оранжевые знаки «плюс») и главные мишени (обведенные знаки «плюс») для связывания с гексамером производных молекулы MDL-A. (Рисунок: osc.edu)
Чтобы создать производное MDL-A, способное состыковаться с D1 в конкретной «горячей точке», Ли использовал скрининговую программу CombiGlide, позволяющую проводить поиск среди более чем 6000 фрагментов лекарственных препаратов. К настоящему моменту он нашел два потенциальных решения, объединив «верхнюю» половину молекулы MDL-A с «нижней» половиной молекулы бензила (benzyl) или молекулы пиразола (pyrazole). Эти кандидаты сохраняют важные особенности связывания, свойственные MDL-A, но являются молекулами с сильными молекулярными связями, которые легче синтезировать, чем оригинальную молекулу MDL-A.
«Хотя мы не обещаем создать полностью готовый препарат за двухгодичный срок проекта, налицо значительный прогресс», - говорит Ли. «Современные исследования дают нам захватывающую терапевтическую парадигму: таргетинг опухолевого микроокружения и подавление обновления стволовых опухолевых клеток, ведущие к действительно эффективному пути преодоления лекарственной резистентности опухолей молочной железы, подавления метастазирования и предотвращения рецидивирования».
Хотя еще и недостаточно эффективные, чтобы рассматриваться в качестве надежного лекарственного препарата, в лабораторных тестах на тканевых образцах производные подтвердили свою более высокую активность по сравнению с оригинальной молекулой MDL-A. Члены исследовательской группы Ли готовятся к проведению более сложных тестов в условиях длительного и тщательно контролируемого процесса оценки.
По материалам
Biophysicist targeting IL-6 to halt breast, prostate cancer

Related Articles: |













