
(© 4designersart - Fotolia.com)
Ученые создали средство маркировки РНК флуорофорами, что позволяет проводить мониторинг синтеза и трафика молекул этой нуклеиновой кислоты внутри живой клетки. Группа из Корнельского университета (Cornell University) сообщает, что разработанная ими методика позволила создать целый ряд комплексов «РНК-флуорофор», светящихся разными цветами видимого спектра.
В частности, один из таких комплексов, названный Шпинатом, напоминает усиленный зеленый флуоресцентный белок (enhanced green fluorescence protein, EFGP) и демонстрирует эквивалентную зеленую флуоресценцию. Описывая свое достижение в журнале Science, авторы методики утверждают, что Шпинат устойчив к фотообесцвечиванию и позволяет визуализировать РНК в живых клетках.
Разработка последовательности РНК со свойствами, аналогичными свойствам зеленого флуоресцентного белка (green fluorescence protein, GFP), которые обеспечивают флуоресценцию при взаимодействии с малой молекулой флуорофора, оказалась сложной задачей: флуоресценция должна была возникать только тогда, когда флуорофор связан с РНК. Антитела и аптамеры, способные вызывать флуоресценцию условно флуоресцентных красителей, известны, но большинство из них могут активироваться и неспецифически или проявлять нежелательные свойства, например, цитотоксичность.
Поэтому целью ученых было выявление малой молекулы, которая флуоресцировала бы только при взаимодействии со специфической последовательностью РНК и не активировалась другими клеточными компонентами. Отправной точкой в поиске стал флуорофор GFP 4-hydroxybenzylidene imidazolinone (HBI) и его производное 3,5-dimethoxy-4-hydroxybenzylidene imidazolinone (DMHBI).
Исследователи разработали молекулы РНК, способные связываться с DMHBI и вызывать флуоресценцию. В результате они получили РНК-аптамеры, взаимодействие которых с DMHBI активировало флуоресценцию с рядом различных цветов. Разработав аптамеры против еще двух GFP-подобных флуорофоров – 4-dimethylaminobenzylidene imidazolinone (DMABI) и 2-hydroxybenzуlidene imidazolinone (2-HBI) – ученые получили еще большее количество цветов флуоресценции.
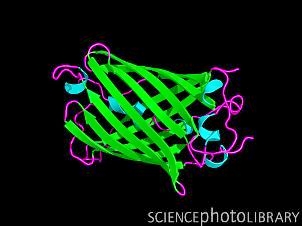
Компьютерная модель вторичной структуры зеленого флуоресцентного белка (GFP). Этот белок содержится в организме медузы Aequorea Victoria. Свойство излучать зеленый свет при освещении ультрафиолетовым или синим сделало его популярным исследовательским инструментом в генетических экспериментах. Ген, кодирующий этот белок, можно ввести в геном любого животного, растения или гриба, и при освещении синим или ультрафиолетовым светом экспрессирующие его клетки и ткани будут светиться зеленым. (Фото:Science Photo Library)
Изучение свойств DMHBI-связывающих аптамеров показало, что эти комплексы имитируют скорее GFP, чем EGFP: EGFP флуоресцирует гораздо ярче, так как существует почти исключительно в депротонированной форме фенолята, а не в форме фенола, свойственной преимущественно GFP. Чтобы получить РНК-флуорофорные комплексы, демонстрирующие спектральные свойства более близкие к EGFP, исследователи синтезировали новое производное HBI – 3,5-difluoro-4-hydroxybenzylidene imidazolinone (DFHBI) – существующее исключительно в форме фенолята и использовали биомиметическую стратегию для получения DFHBI-связывающих РНК.
Один из полученных в результате аптамеров (24-2) демонстрировал спектр возбуждения, соотносимый с эксклюзивным связыванием с фенолятной формой DFHBI. Его молярная яркость составляла около 53% от EGFP, но была больше, чем у многих других флуоресцентных белков. Кроме того, аптамер, как оказалось, преимущественно связывался с фенолятной формой DFHBI даже в условиях низкой рН, при которых существуют как фенолятная, так и фенольная формы.
Обнадеживает, что в отличие от GFP, комплексы 24-2-DFHBI, теперь называемые Шпинатом, демонстрируют незначительное обесцвечивание и начинают флуоресцировать очень быстро после транскрипции в клетках. В отличие от них при использовании GFP наблюдается задержка в флуоресценции, так как необходимо так называемое «созревание» флуорофора.
Подтвердив, что Шпинат можно использовать для получения флуоресценции в клетках E. Coli, ученые перешли к проверке его возможностей в живых клетках млекопитающих. Клетки почек человеческого эмбриона были транфицированы конструкцией, включавшей в себя Шпинат, слитый с 3’ концом малой рибосомальной РНК 5S.
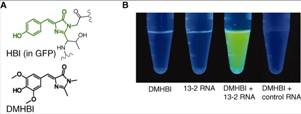
Аптамеры РНК включают флуоресценцию GFP-подобного флуорофора. (А) Структуры HBI (4-hydroxybenzylidene imidazolinone) (показана зеленым) в контексте GFP и DMHBI (3,5-dimethoxy-4-hydroxybenzylidene imidazolinone). (В) 13-2 РНК усиливает флуоресценцию DMHBI. Растворы, содержащие DMHBI, 13-2 РНК, DMHBI с 13-2 РНК и DMHBI с РНК клеток линии HeLa (контроль) сфотографированы при освещении волной 365 нм. (Fig.1, 10.1126/science.1207339)
Флуоресценция комплекса 5S-Шпинат была обнаружена по всей клетке, а ее распределение было аналогично распределению эндогенной 5S в этом же типе клеток. Затем ученые обработали клетки рядом молекул, влияющих на динамику 5S, и смогли отследить синтез и перемещение 5S между ядром и цитоплазмой, а также кластеризацию 5S в гранулах в ответ на обработку сахарозой.
«Мы описали палитру РНК-флуорофорных комплексов, охватывающую большую часть видимого спектра», - заключают авторы. «Молекулы РНК можно помечать Шпинатом, обеспечивая простую стратегию введения компактной флуоресцентной метки для визуализации РНК в живой клетке, избегая при этом проблем, связанных с существующими методами маркировки РНК. Описанные здесь результаты говорят о возможности использования генетически кодируемых РНК-флуорофорных комплексов в других приложениях, включая РНК-РНК и РНК-белковый резонансный перенос энергии флуоресценции и одновременную визуализацию нескольких РНК».
По материалам
Researchers Develop Spectrum of Fluorescent Tags for Monitoring RNA Production and Movement
Аннотация к статье RNA Mimics of Green Fluorescent Protein













