|
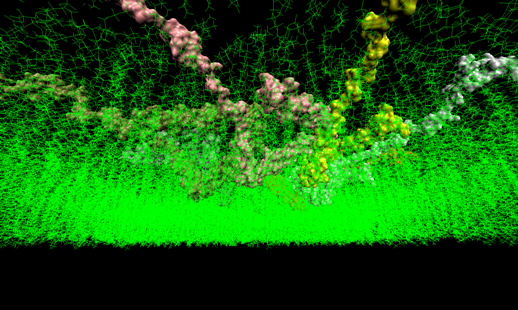
Болезнь Паркинсона и деменция с тельцами Леви – широко распространенные заболевания людей пожилого возраста, характеризующиеся прогрессивным накоплением α-синуклеина в центральной нервной системе. Агрегация α-синуклеина в олигомеры с кольцевидной структурой, как предполагается, играет определенную роль в токсичности. Однако молекулярные механизмы и возможная последовательность событий при образовании пор пока неясны. Используя компьютерное моделирование, ученые изучили процесс олигомеризации в мембранах α-синуклеина дикого типа и мутанта A53T. Исследования показывали, что α-синуклеин быстро проникает в мембраны, меняя свою конформацию с α-спирали на кольцевую структуру. Это проникновение облегчает инкорпорацию в комплекс дополнительных мономеров α-синуклеина и последующую замену фосфолипидов и образование олигомеров в мембране. Этот процесс происходит быстрее и с более выгодной энергией взаимодействия у мутантов A53T по сравнению с диким типом α-синуклеина. За 4 нс моделирования белок-мембранной модели α-синуклеин проникает на глубину в две трети мембраны. К 9 нс проникновение кольцеобразных олигомеров α-синуклеина может привести к образованию порообразных структур, полностью перфорирующих липидный бислой. Экспериментальная инкубация рекомбинантного α-синуклеина в синтетических мембранах привела к образованию аналогичных поровых комплексов. Кроме того, мутантный (A53T) α-синуклеин проявляет более выраженную тенденцию к накоплению в нейрональных мембранах в клеточных культурах, приводя к повышению проницаемости нейронов. Эти исследования дают последовательное молекулярное объяснение процесса олигомеризации α-синуклеина в мембране, а также подтверждают роль образования порообразных структур в патогенезе болезни Паркинсона. (Фото: Igor Tsigelny, San Diego Supercomputer Center and Department of Neurosciences, UC San Diego)
Мощные вычислительные инструменты и лабораторные исследования позволили ученым из Калифорнийского университета в Сан-Диего (University of California, San Diego) найти новые подтверждения правильности некогда проигнорированной теории о первопричине болезни Паркинсона.
Вновь полученные результаты противоречат теории, согласно которой причиной болезни Паркинсона и других нейродегенеративных заболеваний являются нерастворимые внутриклеточные фибриллы – амилоиды. Новые данные дают пошаговое объяснение тому, как «взбесившийся» белок образует агрегаты в мембранах нейронов и прокалывает их, вызывая симптомы болезни Паркинсона.
В статье, опубликованной в журнале FEBS Journal, описывается, как белок α-синуклеин (α-synuclein) может начать работать против нас, особенно с возрастом. Компьютерное моделирования объясняет, как мономеры α-синуклеина проникают в клеточные мембраны, сворачиваются и всего за несколько наносекунд агрегируют в опасные кольцевые структуры, сулящие проблемы нейронам.
По мнению ведущего автора исследования доктора Игоря Цигельного (Igor Tsigelny), научного сотрудника Суперкомпьютерного центра Сан-Диего (San Diego Supercomputer Center) и отделения неврологии Калифорнийского университета в Сан-Диего, замедлив образование и рост этих кольцевых структур, можно создать препараты с антипаркинсоническим эффектом.
Семейная болезнь Паркинсона в большинстве случаях вызывается ограниченным количеством мутаций белка. Одной из самых токсичных мутаций является A53T. Группа Цигельного показала, что эта мутантная форма α-синуклеина не только быстрее, чем нормальный α-синуклеин, пенетрирует мембраны нейронов, но и ускоряет образование колец.
«Самую большую опасность для нейронов пациентов с болезнью Паркинсона, по-видимому, представляют сами относительно небольшие α-синуклеиновые кольцевые структуры», - говорит доктор Цигельный. «Предположение, что за симптомы заболевания ответственны не длинные волокна в нейронах пациентов с болезнью Паркинсона, а эти кольцевые структуры, когда-то воспринималось как ересь; однако, теория колец становится все более и более приемлемой как для этого нейродегенеративного заболевания, так и для других, например, болезни Альцгеймера. Наши результаты подтверждают это изменение в представлениях».
Результаты моделирования согласуются и с изображениями нейронов в мозге пациентов с болезнью Паркинсона, полученными с помощью электронной микроскопии; поврежденные нейроны на них пронизаны кольцевыми структурами.
Не теряя времени, ученые начали охоту на соединения, блокирующие образование колец в мембранах нейронов. Калейдоскоп взаимодействующих в этой сфере сил заставляет α-синуклеиновые белки соударяться и вибрировать, скручиваться и раскручиваться и объединяться в пары или более крупные структуры.
По словам доктора Цигельного, моделирование дает гораздо более глубокое понимание самого таинственного α-синуклеинового белка. Несколько лет назад было показано, что он накапливается в центральной нервной системе пациентов с болезнью Паркинсона и с близким к ней заболеванием – деменцией с тельцами Леви.
Моделирование в деталях показало, как два α-синуклеиновых белка вставляют свои молекулярные пальцы в мембрану нейрона, протискиваются в нее всего за несколько наносекунд и сразу же объединяются в пару. Эта пара сама по себе нетоксична; однако по мере того, как к этому «танцу» присоединяется все большее количество белков, ключевой порог, в конце концов, оказывается преодоленным; полимеризация ускоряет повреждение клетки кольцевыми структурами, перфорирующими ее мембрану.
Фактически, чтобы убить нейроны, известные своей долговечностью, требуется много кольцевых структур. Нервные клетки в состоянии восстановить десятки вызванных кольцами перфораций, успевая защищаться от α-синуклеиновой атаки. Но в какой-то момент скорость перфорирования превосходит возможности нейронов к самовосстановлению. Как результат, появляются и постепенно усугубляются симптомы болезни Паркинсона.
«Мы считаем, что можно создать препарат, останавливающий полимеризацию α-синуклеина на стадии димеров», - полагает доктор Цигельный. «Прервав полимеризацию на этой критической стадии, мы смогли бы значительно замедлить развитие заболевания».
Основываясь на более глубоком понимании полимерации α-синуклеина в нейронах, сейчас ученые сосредоточили свое внимание на понимании того, как происходит слипание мономеров. Их поиск соединений-кандидатов в лекарственные препараты будет включать в себя молекулы, индуцирующие различные конформации α-синуклеиновых белков, менее предрасположенные к слипанию друг с другом. Даже слабо выраженный этот эффект мог бы смягчить симптомы.
Вычислительный подход, использованный группой доктора Цигельного, включает в себя изучение многих возможных трехмерных организаций димеров, тримеров и тетрамеров α-синуклеина. Фармацевтические компании используют варианты такого подхода для разработки лекарств-кандидатов, предназначаемых для связывания с «якорными остатками» или «горячими точками» в белках-мишенях. В виртуальных экспериментах алгоритмы оценивают теоретическую способность тысяч соединений связываться с человеческими белками из постоянно расширяющейся базы данных известных 3-D структур этих белков.
Однако попытки найти препараты таким способом приводят к выявлению перспективных кандидатов, которые терпят неудачу в клинических испытаниях с регулярностью, дорого обходящейся разработчикам.
«Исходя из этих ошибок, мы пришли к пониманию, что белки меняют свою форму так часто, что то, что казалось основной мишенью препарата, может существовать одну наносекунду, затем измениться или не быть актуальным изначально», - объясняет доктор Цигельный – физик, ставший разработчиком лекарственных препаратов.
Подход доктора Цигельного использует преимущества классических алгоритмов создания препаратов, но добавляет дополнительные аналитические методы, чтобы расширить поиск включением того, как конформация-мишень белка изменяется в ответ на силы, действующие в молекулярных масштабах.
«Иногда модели, используемые для разработки лекарств, несмотря на «красивый вид», могут быть совершенно ошибочными. Ученым, занимающимся разработкой препаратов, нужно знать, когда и в какой степени им можно доверять. Даже незначительный сдвиг в параметрах окружающей клетку среды может коренным образом изменить взаимодействие белков с соседними молекулами. Мы считаем, что, придя к фундаментальному пониманию вовлеченных в их развитие белков, вполне реально разработать препараты для лечения нейродегенеративных заболеваний, таких как болезнь Паркинсона, и других болезней, например, диабета».
По материалам
Scientists Uncover Strong Support for Once-Marginalized Theory on Parkinson’s Disease
Оригинальная статья:
Role of α-synuclein penetration into the membrane in the mechanisms of oligomer pore formation
© «Первопричиной болезни Паркинсона является перфорация мембран нейронов олигомерами α-синуклеина». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Вести из лабораторий.
Related Articles: |













