|
Теломераза – фермент, который «охраняет» нашу ДНК на концах хромосом, в так называемых теломерах. При отсутствии теломеразной активности каждый раз, когда клетка делится, теломеры становятся короче. Это составная часть естественного процесса старения, так как в большинстве клеток организма человека теломераза неактивна. В конечном итоге выполняющие функцию защитных колпачков на концах хромосом теломеры становятся настолько короткими, что клетки умирают.
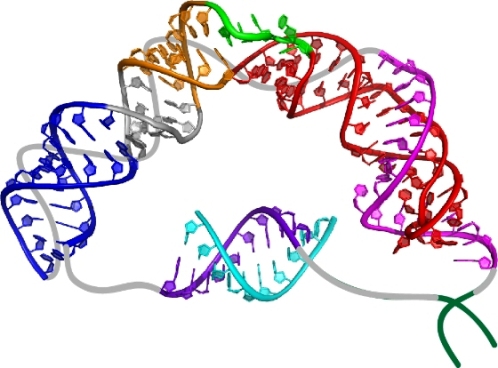
Модель «ключевого домена» РНК теломеразы, полученная Джули Фейгон, Ци Чжаном и их коллегами из лаборатории Фейгон в Университете Калифорнии – Лос-Анджелес. (Фото: Juli Feigon, UCLA Chemistry and Biochemistry/PNAS)
Но в некоторых клетках, таких как раковые, теломераза, состоящая из РНК и белков, очень активна и постоянно добавляет ДНК к теломерам, предотвращая их укорачивание и, таким образом, продлевая жизнь клетки.
Биохимики из Университета Калифорнии – Лос-Анджелес (University of California – Los Angeles - UCLA) получили трехмерную структурную модель основного домена РНК фермента теломеразы. Так как этот фермент играет важнейшую роль в процессе старения и развитии рака, понимание его структуры может привести к разработке новых подходов к лечению заболеваний.
«Мы до сих пор точно не знаем, как РНК и белки творят это волшебство – продлевают концы наших теломер – но теперь мы на шаг ближе к пониманию этого процесса», - говорит профессор кафедры химии и биохимии UCLA Джули Фейгон (Juli Feigon), главный автор исследования, опубликованного в печатном издании Proceedings of the National Academy of Sciences.

Член Национальной академии наук США профессор биохимии Джули Фейгон (Juli Feigon). (Фото: biochemistry.ucla.edu/biochem/Faculty/Feigon)
Ключевой домен РНК-компонента теломеразы необходим ферменту для добавления повторов к концам хромосом, структурам, содержащим наши гены. Он содержит шаблон, используемый для кодирования этих повторов.
«Теломераза – удивительнейший комплекс», – говорит Фейгон, начавшая изучение структуры ДНК теломер в начале 90-х годов, что и вызвало ее интерес к теломеразе. «Существует мнение, что, активировав теломеразу, мы сможем увеличить продолжительность жизни. Однако нам не нужно, чтобы наши клетки сохраняли способность делиться неопределенно долго. По мере того, как они все больше и больше стареют, в них происходит накопление всех возможных видов повреждений и дефектов ДНК. Поэтому в большинстве клеток нам не нужен высокий уровень активности теломеразы».
Так как раковые клетки делятся быстро, их теломеры укорачиваются быстрее, чем в нормальных клетках. Но в то время как в большинстве типов здоровых клеток нашего организма теломераза имеет низкий уровень активности, высокий уровень ее активности в раковых клетках помогает восстанавливать их теломеры. Раковые клетки, по словам Фейгон, «становятся бессмертными» благодаря теломеразе, способствующей раковой прогрессии.
«Понимание того, как работает теломераза, заключает в себе огромный потенциал для лечения заболеваний», - считает ученый.
Она и сотрудники ее лаборатории изучают структуру теломеразы на очень глубоком уровне, что позволяет получить представление о ее функции. Однако Фейгон подчеркивает, что лаборатория проводит фундаментальные научные исследования и не занимается разработкой методов лечения рака.
Исследование финансировалось Национальным институтом здравоохранения (National Institutes of Health), Национальным научным фондом (National Science Foundation) США и другими организациями.
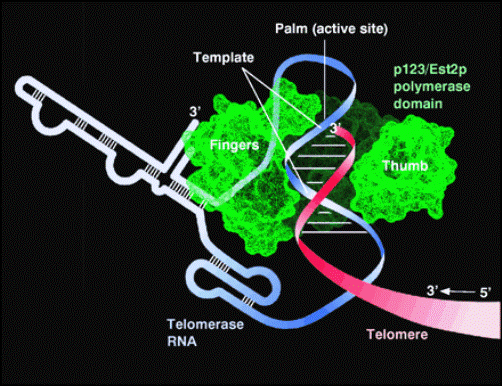
Теломераза – фермент, удлиняющий теломеры. (allscienceconsidered.wordpress.com)
Ключевой домен РНК теломеразы состоит из трех частей: «псевдоузла», необходимого для проявления активности фермента, в центре которого сходятся три нити РНК, образуя тройную спираль; «внутренней выпуклой петли», значение которой часто недооценивалось и которая оказалась очень важной; «спирального расширения» - все из которых Фейгон и ее коллеги смоделировали, используя разработанный ими новый метод. Определение структур проводилось с помощью самой современной ядерной магнитно-резонансной (ЯМР) спектроскопии.
Соединив вместе три части РНК-компонента теломеразы – псевдоузел, внутреннюю выпуклую петлю и спиральное расширение, Фейгон и ее коллеги создали трехмерную модель.
«Чтобы получить трехмерную модель основного домена, мы сложили вместе три его части, впервые сделав это с высоким разрешением. С точки зрения изучения функции теломеразы это было потрясающе, так как впервые мы получили конструктивную модель формы этой важнейшей части РНК»,- говорит Фейгон, избранная в 2009 году в Национальную академию наук (National Academy of Sciences) США.
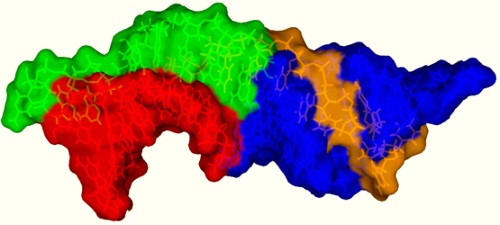
Структура псевдоузла РНК-компонента теломеразы человека.(Фото:biochemistry.ucla.edu/biochem/Faculty/Feigon)
Новое исследование, по ее мнению, может привести к выявлению мишеней для лекарственных препаратов.
«Если мы хотим найти в теломеразе мишени для лекарственных препаратов, нам нужно знать, как она функционирует на каждом этапе клеточного цикла», - говорит Фейгон. «Если известна трехмерная структура каждого белка или нуклеиновой кислоты, участвующих в жизнедеятельности клетки, вероятность адресно связать их с малыми молекулами или другими фармацевтическими препаратами, чтобы заблокировать или активировать, неизмеримо возрастает».
Существуют заболевания, при которых мутация в теломеразной РНК или в теломеразном белке приводит к инактивации фермента.
«Мы пытаемся составить общую картину с точки зрения структурной биологии, включая функции фермента и то, как его можно инактивировать», – говорит Ци Чжан (Qi Zhang), постдокторант в лаборатории Фейгон и ведущий автор статьи. «То, о чем мы сообщаем, уже содержит много информации».
Ученые, описавшие, как теломеры защищают хромосомы, получили Нобелевскую премию по физиологии и медицине за 2009 год. И все же о структурной биологии фермента известно еще очень немного; его полная трехмерная структура пока не установлена. При этом почти вся информация о трехмерной структуре РНК теломеразы позвоночных получена в лаборатории Фейгон.

Лауреаты Нобелевской премии по физиологии и медицине за 2009 год (слева направо): Элизабет Блэкберн, Кэрол Грейдер и Джек Шостак. (Фото: nihrecord.od.nih.gov, chronicle.pitt.edu, knaw.nl)
«Если о биохимии фермента мы знаем достаточно много, то о том, как рибонуклеиновый и белковый компоненты взаимодействуют друг с другом в трехмерной структуре, почти ничего неизвестно», - комментирует Фейгон. «Мы решили изучить структуру внутренней петли и ее динамику. Определив структуру, мы обнаружили совершенно неожиданную сборку, приводящую к большому изгибу РНК. Тогда мы провели биохимическое исследование, показавшее, что этот изгиб и его пластичность важны для активности теломеразы. Оказалось, что внутренняя выпуклая петля очень важна для определения топологии домена».
Структура и динамика внутренней выпуклой петли важны для каталитической активности фермента.
«Мы изучили базу данных всех структур РНК, которые были определены к тому моменту, и оказалось, что существует еще одна структура, имеющая тот же тип петли из пяти нуклеотидов. Вторая структура принадлежала РНК-домену вируса гепатита С. Это оказалось для нас большим сюрпризом. Еще больше удивило нас то, что нуклеотидная последовательность вирусной петли была совершенно другой, а структура почти идентичной. Она также очень важна для функции вируса: если ее разрушить, вирус гепатита С становится менее патогенным», - объясняет Фейгон.
Чтобы активировать теломеразу, необходима теломеразная РНК и белок, называемый теломеразной обратной транскриптазой (telomerase reverse transcriptase – TERT). Хромосомы состоят из последовательностей нуклеотидов, представленных буквами A, C, G и Т. С всегда связывается с G, в то время как А – с Т. Соединившись, нуклеотиды составляют трехбуквенный код, в котором зашифрованы аминокислоты. Соответствующие аминокислоты объединяются при синтезе белков.
«Теломераза содержит РНК-шаблон, являющийся кодом повторов ДНК теломер», - объясняет Фейгон. «Вместо буквы А такой шаблон содержит Т, а вместо G – C. Копирование ДНК с шаблона РНК вместо копирования РНК с ДНК называется обратной транскрипцией. Основной домен теломеразы включает в себя шаблон, позволяющий осуществлять такую транскрипцию. Вирус ВИЧ также имеет обратную транскриптазу, копирующую шаблон РНК в ДНК. Обратные транскриптазы обычно копируют РНК в ДНК, но не содержат РНК; в теломеразе для функционирования белка необходим РНК-компонент».
Теломераза уникальна, так как ее РНК-шаблон является частью самого фермента и используется для копирования сначала одного теломерного повтора, затем другого и так далее. Все синтезированные повторы соединяются друг с другом. Таким образом, теломераза восстанавливает теломеры. Теломераза имеет свою собственную внутреннюю РНК, используемую для копирования в ДНК, но этот шаблон имеет длину всего около 10 из 451 нуклеотида.
Теломеразу чрезвычайно трудно охарактеризовать с точки зрения структуры из-за ее размера и сложности, а также из-за низкого уровня содержания в нормальных клетках.
Лаборатория Фейгон занимается изучением 3-D структуры ДНК и РНК и проблемой взаимного распознавания ДНК, РНК и белков, регулирующего активность генов. Фейгон первой использовала ядерную магнитно-резонансную спектроскопию для определения структуры ДНК и РНК. В своих исследованиях она использует широкий диапазон молекулярно-биологических, биохимических и биофизических методов.
Интуиция часто играет важную роль в науке. Когда в начале 90-х годов Фейгон начала свои исследования на теломерах и теломеразе, она даже не думала о раке. Ее интересовала структура ДНК.
По материалам
New 3-D model of RNA 'core domain' of enzyme telomerase may offer clues to cancer, aging
Аннотация к статье Structurally conserved five nucleotide bulge determines the overall topology of the core domain of human telomerase RNA
© «Новая 3-D модель ключевого домена РНК фермента теломеразы». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на сайт LifeSciencesToday.
Related Articles: |













