|
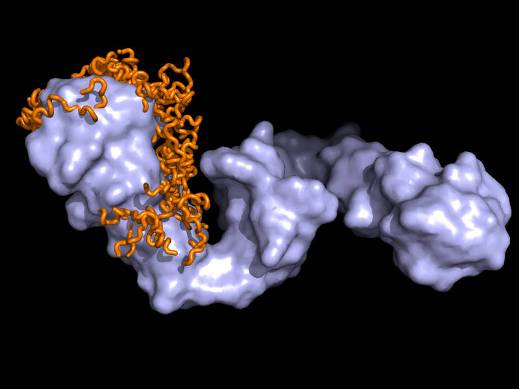
Хотя Hsp90 обычно предпочитает уже свернутые белки, он, тем не менее, связывается с тау-белком, ответственным за развитие болезни Альцгеймера. Международная группа ученых расшифровала молекулярные механизмы распознавания шапероном Hsp90 тау-белка. На снимке белковый комплекс Hsp90 – тау (Hsp90 светло-голубой, тау-белок оранжевый). (Фото: Tobias Madl/Technische Universität München/Helmholz Zentrum München)
Тау-белок, непосредственно связанный с развитием болезни Альцгеймера, взаимодействует с белком фолдинга шапероном Hsp90. Исследовательская группа во главе с учеными Мюнхенского технического университета и Мюнхенского центра имени Гельмгольца опубликовала статью в журнале Cell, в которой объясняет, какие молекулярные механизмы распознавания играют роль в этом взаимодействии, и предлагает новую фармакологическую мишень для лечения этого смертельного заболевания.
Белки, такие как белок теплового шока Hsp90, играют важную роль практически во всех процессах, протекающих в клетках человека. Они помогают другим белкам свертываться в трехмерные структуры или восстанавливают правильную конфигурацию поврежденных белковых молекул.
В последнее время ученые получают все больше доказательств того, что белок теплового шока Hsp90 участвует в фолдинге тау-белка. Скопления тау-белка в клетках головного мозга характерны для болезни Альцгеймера и несут ответственность за дегенерацию нервных клеток.
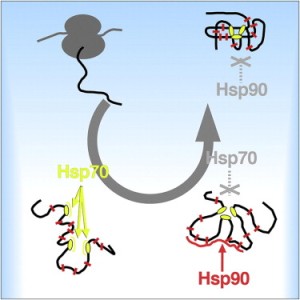
Фолдинг белков в клетке основан на скоординированном действии консервативных семейств шаперонов – систем Hsp70 и Hsp90. Hsp70 действует на ранней стадии, а Hsp90 в конце фолдинга, но молекулярная основа такого тайминга является загадкой, что, главным образом, объясняется недостаточной изученностью субстратной специфичности Hsp90. Немецкие и голландские ученые получили структурную модель Hsp90 в комплексе с его естественным, связанным с болезнью Альцгеймера, субстратом – внутренне неупорядоченным белком тау. Hsp90 связывается с широкой областью тау, включающей предрасположенные к агрегации повторы, взаимодействующей с микротрубочками. Кроме того, субстрат-связывающий интерфейс Hsp90 длиной 106 Å делает возможными многие контакты с низкой аффинностью и узнавание рассеянных гидрофобных остатков в поздних интермедиатах свертывания, остающихся после раннего связывания сайтов шаперона Hsp70. Эта модель разрешает парадокс, как Hsp90 одновременно специфически выбирает поздние интермедиаты фолдинга и некоторые внутренне неупорядоченные белки: с точки зрения Hsp90 они выглядят одинаково. (Рис. Cell)
Шаперон Hsp90 связывается преимущественно с белками, уже прошедшими раннюю стадию фолдинга. Находящиеся же в растворе молекулы тау-белка больше похожи на длинные вытянутые цепочки. Почему Hsp90, тем не менее, взаимодействует с тау, выяснил доктор Тобиас Мадль (Tobias Madl), руководитель рабочей группы BioSysNet, младший научный сотрудник Мюнхенского технического университета (Technische Universität München), лидер группы структурной биологии сигнальной трансдукции Эмми Нётер в Институте структурной биологии (Institut für Strukturbiologie) Мюнхенского центра Гельмгольца (Helmholz Zentrum München). Соавтором исследования является профессор Стефан Рюдигер (Stefan Rüdiger) из Утрехтского университета (University of Utrecht), Нидерланды.
Используя магнитно-резонансную спектроскопию, малоугловое рентгеновское рассеяние и компьютерное моделирование, ученые определили структуру и динамику взаимодействия между двумя биомолекулами. Исходя из этой информации, они установили, как Hsp90 распознает и связывает тау: для Hsp90 тау-белок выглядит как свернутый белок большого размера. Кроме того, исследователям удалось пролить свет на то, как Hsp90 влияет на агрегацию молекул тау.
«Отложения тау-белка могут привести к развитию болезни Альцгеймера. Мы установили ту область белка, в которой происходит взаимодействие между его молекулами. Это новая и важная отправная точка для влияния на формирование этой структуры и для разработки будущих терапевтических препаратов для лечения болезни Альцгеймера», - комментирует доктор Мадль.
Агрегация белков является причиной не только болезни Альцгеймера, но и других нейродегенеративных заболеваний, а шапероны играют значительную роль в развитии рака и фиброзного кистоза. Таким образом, эти открытия могут лечь в основу более глубокого понимания механизмов развития всех этих болезней.
По материалам
Faltungsprotein bindet für Alzheimer verantwortliches Protein. Gefährliche Verwechslung
Оригинальная статья:
G. Elif Karagöz, Afonso M.S. Duarte, Elias Akoury, Hans Ippel, Jacek Biernat, Tania Morán Luengo, Martina Radli, Tatiana Didenko, Bryce A. Nordhues, Dmitry B. Veprintsev, Chad A. Dickey, Eckhard Mandelkow, Markus Zweckstetter, Rolf Boelens, Tobias Madl, Stefan G.D. Rüdiger. Hsp90-Tau Complex Reveals Molecular Basis for Specificity in Chaperone Action
© «Опасная ошибка: шаперон связывает белок, ответственный за болезнь Альцгеймера». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Болезнь Альцгеймера.
Related Articles: |













