|
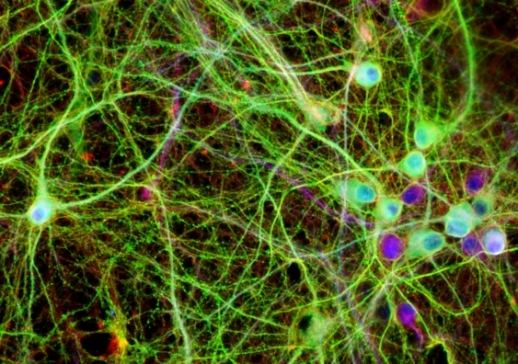
Процесс развития болезни Альцгеймера связан с образованием бляшек из белка бета-амилоида и клубков из тау-белка. Согласно господствующим сегодня представлениям, бета-амилоид индуцирует фосфорилирование тау-белка, который, в свою очередь, опосредует дисфункцию нейронов. Работая с мышиными моделями болезни Альцгеймера, профессор Ларс Иттнер с коллегами нашли доказательства защитной роли тау на ранней стадии болезни Альцгеймера. Эта защита включает в себя специфическое фосфорилирование тау по треонину 205 у постсинапса. Защитная роль фосфорилированного тау бросает вызов догме, что фосфорилирование тау только опосредует токсические процессы. На снимке культура нейронов. Человеческий тау-белок показан зеленым, структурные компоненты – красным, ДНК в клеточном ядре – синим. (Фото: UNSW/Lars Ittner)
Австралийские ученые пролили новый свет на нервные процессы в головном мозге, связанные с развитием болезни Альцгеймера. Они подвергают сомнению общепринятые теории патогенеза этого нейродегенеративного заболевания и, возможно, открывают двери новым методам лечения, способным остановить или замедлить прогрессирование болезни. Результаты их исследования опубликованы в журнале Science.
Изучая ткани человеческого мозга, группа ученых из Университета Нового Южного Уэльса (University of New South Wales) и Neuroscience Research Australia идентифицировала белок, киназу p38γ, уровни которого падают по мере прогрессирования болезни Альцгеймера. Введение этого белка в мозг мышей оказало положительное действие, предотвращая нарушения памяти, связанные с этим заболеванием.
По словам руководителя исследования профессора UNSW Ларса Иттнера (Lars Ittner), «это исследование полностью изменило наше понимание происходящего в головном мозге в процессе развития болезни Альцгеймера».
Два из признаков болезни Альцгеймера – это присутствие в головном мозге белковых бляшек из бета-амилоида и клубков из тау-белка, накопление которых связано с гибелью клеток, атрофией мозга и потерей памяти.
Исследователи показали, что критический шаг в процессе образования клубков до сих пор оставался понятым неправильно. Как считалось ранее, образующий бляшки белок, бета-амилоид, вызывает модификацию (фосфорилирование) тау-белка, что приводит к гибели клеток и, в конечном итоге, к болезни Альцгеймера. Усиленное фосфорилирование тау-белка в конечном счете приводит к его накоплению в виде клубков.
Результаты же нового исследования свидетельствуют о том, что фосфорилирование тау-белка первоначально оказывает протекторное действие на нейроны и что бета-амилоид постепенно подавляет эту защитную функцию вплоть до ее потери. На этом этапе высокая токсичность вызывает разрушение нейронов и приводит к когнитивным нарушениям, характерным для болезни Альцгеймера.
«Бета-амилоид индуцирует токсичность в нейронах, а фосфорилирование тау на первом этапе фактически направлено на снижение этой токсичности», - объясняет профессор Иттнер. «То, что в действительности причина модификации тау – это защита от повреждения, – совершенно новый взгляд на проблему».
Чтобы идентифицировать белок – киназу p38γ, – способствовавший защитному фосфорилированию тау-белка и препятствующий повышению токсичности, индуцируемой бета-амилоидом, ученые использовали различные модели мышей и ткани мозга человека.
«Мы использовали мышей для скрининга очень специфической токсичности, которая, как мы знали из предыдущей работы, связана с прогрессией заболевания», - продолжает Иттнер. «Мы задались целью найти медиаторы этой прогрессии, что быстро привело нас к нашему неожиданному открытию. Оно полностью противоречило тому, что мы ожидали. И только тогда, когда мы изменили свое представление о процессе, участвующем в развитии болезни Альцгеймера, в этих результатах стал виден смысл».
Изучая ткань человеческого мозга, профессор Иттнер и его коллеги выяснили, что по мере прогрессирования болезни Альцгеймера уровни p38γ снижаются, однако небольшое его количество все же остается.
«Мы установили, что в мозге людей с болезнью Альцгеймера p38γ, который сначала защищает, рано исчезает, что предполагает потерю защиты», - комментирует профессор. «Часть нашего исследования включала в себя реинтродукцию белка p38γ и повышение его активности. Мы видели, что у мышей он предотвратил нарушение памяти, и, следовательно, он обладает действительным терапевтическим потенциалом. Научившись стимулировать эту активность, мы, возможно, сможем задержать или даже остановить прогрессирование болезни Альцгеймера».
Следующим шагом австралийских ученых будет разработка новых медицинских препаратов на основе их запатентованных открытий.
По материалам
Discovery opens door to new Alzheimer's treatments
Оригинальная статья:
А. Ittner, S. W. Chua, J. Bertz, A. Volkerling, J. van der Hoven, A. Gladbach, M. Przybyla, M. Bi, A. van Hummel, C. H. Stevens, S. Ippati, L. S. Suh, A. Macmillan, G. Sutherland, J. J. Kril, A. P. G. Silva, J. Mackay, A. Poljak, F. Delerue, Y. D. Ke, L. M. Ittner. Site-specific phosphorylation of tau inhibits amyloid-β toxicity in Alzheimers mice
© «Исследование бросает вызов догме: фосфорилирование тау-белка защищает нейроны при болезни Альцгеймера». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Болезнь Альцгеймера. Письменное разрешение обязательно.
Related Articles: |













