|

Используя возможности своего роботизированного микроскопа, Стив Финкбайнер (Steve Finkbeiner) (слева) и Гайя Скибински (Gaia Skibinski) доказали, что уникальное взаимодействие двух белков может являться драйвером самого распространенного генетического механизма развития болезни Паркинсона. (Фото: Chris Goodfellow)
Вы пытаетесь написать историю жизни человека, но все, на что вы можете рассчитывать, это несколько фотографий. Но самое трудное даже не это. Так как на каждой фотографии несколько тысяч других людей, человек, которого вы ищете, – это лишь одно из моря лиц. Что можно реально узнать о его жизни? Можно ли узнать, где он рос, на кого был похож, когда умер? Можно ли вообще отыскать его?
Часто это та суровая реальность, с которой сталкиваются ученые, пытаясь понять, что происходит с отдельными клетками, становящимися жертвами болезней. И это особенно верно, если речь идет об изучении заболеваний головного мозга, таких как болезни Альцгеймера, Паркинсона и Хантингтона, – нейродегенеративных заболеваний, для которых характерна гибель отдельных нейронов и, как результат, нарушение функций мозга. Часто у ученых нет выбора, и они вынуждены оценивать влияние заболевания на клеточную популяцию, а не на отдельную клетку. В результате понимание причин и механизмов развития болезни остается неполным – серьезный барьер на пути к разработке эффективных методов лечения.
С этой проблемой несколько лет назад столкнулся и невролог из Института Гладстона (Gladstone Institutes) Стив Финкбайнер (Steve Finkbeiner), MD, PhD. Но, вооруженный изобретательностью и решимостью, он сконструировал единственный в своем роде роботизированный микроскоп с уникальными возможностями: прибор позволяет отслеживать рост, развитие, созревание и, в конечном итоге, поражение болезнью отдельных нейронов. Этот микроскоп уже помог доктору Финкбайнеру и его группе достичь больших успехов в различных областях неврологии, и теперь, используя уже третью его «реинкарнацию», ученые получили новую ценную информацию о болезни Паркинсона. Результаты этого исследования опубликованы в журнале The Journal of Neuroscience.
Самым драматичным аспектом болезни Паркинсона, возможно, являются не симптомы этого заболевания, лишающие пациентов способности контролировать свои движения, и даже не то, что от него страдают миллионы людей и их семьи, а то, что в большинстве случаев остаются загадкой причины его развития. В своем последнем исследовании доктор Финкбайнер и его исследовательская группа сосредоточили свое внимание на LRRK2 (leucine-rich repeat kinase 2, обогащенная лейциновыми повторами киназа 2) – белке с киназной активностью, мутации в котором являются наиболее распространенной генетической причиной болезни Паркинсона. Ученые установили, что уникальная связь LRRK2 с другим белком мозга может фактически стимулировать прогрессирование болезни Паркинсона. Кроме того, исследователям удалось наметить потенциальную стратегию блокирования этого токсического процесса.
Ученым уже давно известно, что мутации в киназе LRRK2 приводят к накоплению в нейронах неправильно свернутых молекул этого белка. Общепризнанная гипотеза состоит в том, что неправильно свернутая LRRK2 обладает повышенной киназной активностью и эта повышенная активность является причиной гибели клеток. Кроме того, как еще один фактор, способствующий прогрессированию болезни Паркинсона, обращает на себя внимание тот факт, что мутантная LRRK2 проявляет тенденцию к слипанию в так называемые тельца включения.
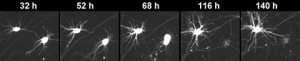
Последовательные изображения двух нейронов, полученные в течение пяти дней. Верхний нейрон чувствует себя хорошо на протяжении всех пяти дней, в то время как нижний начинает дегенерировать на третий день. На четвертый день он погибает. Отслеживая судьбу нейронов в динамике, ученые имеет гораздо больше возможностей обнаружить различия между нейронами с нормальной и мутантной киназой LRRK2. (Фото: Gaia Skibinski)
«Как результат, в качестве показателя вредных эффектов LRRK2 ученые используют присутствие телец включения и повышенную киназную активность, а не оценку уровней самой LRRK2», - объясняет доктор Финкбайнер. «Но мы не были уверены, что это и есть основные причины клеточной гибели, и поэтому решили изучить происходящее в клетках более подробно».
Доктор Финкбайнер и его коллеги изучили нейроны, полученные из двух источников – генетически модифицированных крыс с мутантной версией LRRK2 и пациентов с LRRK2-ассоциированной болезнью Паркинсона. Из клеток кожи таких пациентов с помощью новейшей технологии были получены индуцированные плюрипотентные стволовые клетки. Этот метод, разработанный Нобелевским лауреатом 2012 года Шинья Яманака (Shinya Yamanaka) MD, PhD, позволяет перепрограммировать взрослые клетки кожи в клетки практически идентичные стволовым. Такие стволовые клетки можно затем дифференцировать почти в любую клетку организма.
В этом исследовании полученные из клеток пациентов нейроны демонстрировали тот же паттерн дегенерации и гибели, что наблюдается в мозге пациентов. Изучение этих моделей позволило исследователям увидеть, как мутация в LRRK2 активирует нейродегенерацию, а затем, используя возможности роботизированного микроскопа, отследить дальнейшую судьбу человеческих и крысиных нейронов, проведя мониторинг накопления мутантного белка LRRK2, и то, как это накопление связано с гибелью клеток.
«В обеих моделях мы обнаружили, что ни тельца включения, ни киназная активность не были непосредственными причинами токсичности, ведущей к гибели нейронов», - комментирует результаты исследования доктор Гайя Скибински (Gaia Skibinski), ведущий автор статьи. «Основная причина, по-видимому, связана непосредственно с накоплением диффузной мутантной LRRK2».
Заглянув еще глубже в жизнь этих нейронов, исследователи увидели нечто интригующее – уникальное взаимодействие между мутантной LRRK2 и альфа-синуклеином, еще одним белком, уже давно связываемым с болезнью Паркинсона. Предыдущие исследования показали, что у пациентов с LRRK2-ассоциированной болезнью Паркинсона часто наблюдается и аномальное накопление альфа-синуклеина. Но до сих пор точный характер взаимосвязи этих двух белков оставалась неясным.
«Важно отметить, что как в крысиных, так и человеческих клеточных моделях удаление альфа-синуклеина снижает связанную с LRRK2 гибель клеток, что совершенно неожиданно», - продолжает доктор Скибински. «При дальнейшем изучении мы обнаружили, что удаление альфа-синуклеина приводит к немедленному падению уровней LRRK2. Насколько нам известно, это первое доказательства того, что данный тип нейродегенерации можно остановить простой элиминацией альфа-синуклеина».
Исследователи предполагают, что у пациентов с мутантным белком LRRK2 накопление альфа-синуклеина нарушает способность клетки удалять LRRK2, что и приводит к накоплению киназы. Со временем накопление мутантной LRRK2 начинает оказывать на клетку токсическое действие, и клетка погибает.
«Наше открытие этой «синергии» двух белков, роль которых в развитии болезни Паркинсона давно известна, является огромным шагом на пути к разработке лекарств, атакующих основные механизмы болезни», - подводит итог доктор Финкбайнер. «Все глубже раскрывая точную функциональную связь между альфа-синуклеином и LRRK2, мы успешно продвигаемся к тому, что остановить наступление болезни Паркинсона на мозг».
По материалам
Two Proteins’ Destructive Dance
Оригинальная статья:
Gaia Skibinski, Ken Nakamura, Mark R. Cookson, Steven Finkbeiner. Mutant LRRK2 Toxicity in Neurons Depends on LRRK2 Levels and Synuclein But Not Kinase Activity or Inclusion Bodies
© «Причины болезни Паркинсона: разрушительный танец двух белков». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Болезнь Паркинсона.
Еще об исследованиях доктора Финкбайнера
Развитию болезни Хантингтона способствует неспособность нейронов удалять токсичные белки, а не только их образование
и ингибиторах киназ для лечения болезни Паркинсона
Разрабатывается ингибитор киназ, атакующий болезнь Паркинсона с двух флангов
Related Articles: |













