
Числовые модели левозакрученных спиралей амилоидных волокон из бета-лактоглобулина. (Picture: Prof. R. Mezzenga, ETH Zurich)
Учеными университета Лидса ( University of Leeds), Великобритания, найдена молекула, способная останавливать формирование длинных белковых нитей, известных как амилоидные фибриллы, вызывающих суставные боли у пациентов, находящихся на почечном диализе. Это открытие может способствовать разработке новых методов выявления препаратов для профилактики, лечения или остановки прогрессирования заболеваний, в развитии которых определенную роль играют амилоидные фибриллы, в том числе болезней Альцгеймера, Паркинсона и диабета 2 типа.
Статья об исследовании, финансируемом Исследовательским советом по биотехнологиям и естественным наукам (Biotechnology and Biological Sciences Research Council) и Wellcome Trust, опубликована в журнале Nature Chemical Biology.
Исследовательская группа из Центра структурной молекулярной биологии Астбери (Astbury Centre for Structural Molecular Biology) факультета биологических наук Университета Лидса установила, что антибиотик Рифамицин SV (Rifamycin SV) способен предотвращать сборку в фибриллы белка β2-микроглобулина (β2microglobulin, β2m). Как известно, β2-микроглобулин накапливается у находящихся на почечном диализе пациентов и образует амилоидные фибриллы в суставах, вызывая сильнейшие боли и артрит.
Используя специализированный аналитический метод, называемый спектрометрией ионной подвижности – масс-спектрометрией (ion mobility spectrometry-mass spectrometry, IMS-MS), ученые смогли увидеть, на какой стадии процесса Рифамицин SV предотвращает образование амилоидных фибрилл. Они считают, что эта технология позволит идентифицировать потенциальные препараты для многих других образующих амилоидные фибриллы белков, ассоциируемых с широким спектром заболеваний.
«Традиционная разработка лекарственных препаратов для таких заболеваний, как болезнь Альцгеймера, невероятно трудна, так как белки, которые мы пытаемся сделать мишенями, постоянно меняют форму и структуру», - объясняет профессор структурной молекулярной биологии Университета Лидса Шина Рэдфорд (Sheena Radford). «Это все равно, что раз за разом пытаться найти одну бусину определенной формы в коробке с миллионами очень похожих бусин. Новая технология позволяет нам видеть форму белка в процессе ее изменения, и поэтому нам легче точно определить, какая часть белка может стать мишенью».
В своем нормальном, свернутом, состоянии белки не могут связываться друг с другом и образовывать длинные фибриллярные скопления, но при развернутой конфигурации это становится возможным. Сначала они образуют небольшие группы из двух, трех или четырех белков, которые затем объединяются в длинные нити, сплетающиеся между собой и формирующие амилоидные фибриллы.
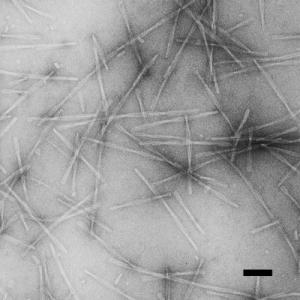
Амилоидные фибриллы. (Фото: eurekalert.org)
Большинство аналитических методов показывают только массу белка или его аминокислотный состав, при этом при развертывании белка ни то, ни другое не изменяется. Другие неспособны «рассмотреть» отдельные молекулы в сложных смесях. Метод IMS-MS может измерить массу и оценить форму белка, позволяя ученым наблюдать за процессом его развертывания и агрегирования в небольшие группы, а затем и сборки в фибриллы, и определить, какое из соединений способно связать лиганд и остановить процесс сборки.
Исследователи установили, что Рифамицин SV останавливает образование амилоидных фибрилл, связываясь с молекулой развернутого белка определенной формы. Это первый случай выявления такого белка в качестве мишени для разработки новых ингибиторов сборки фибрилл.
«Нам посчастливилось быть в числе немногих университетов Великобритании, которые используют метод IMS-MS для изучения образования амилоидных фибрилл», - говорит профессор кафедры биомолекулярной масс-спектрометрии Элисон Эшкрофт (Alison Ashcroft), специализирующаяся на этом виде анализа. «В организме амилоидные фибриллы формируются в течение многих лет, а в лаборатории мы можем «вырастить» их за несколько часов. Используя метод IMS-MS, мы можем лучше понять механизм того, как это происходит, и, надеемся, найти способы остановить этот процесс».
По материалам
Research offers new way to target shape-shifting proteins
Аннотация к статье Ligand binding to distinct states diverts aggregation of an amyloid-forming protein













