|

Заместитель директора Института регенеративной медицины (Institute for Regenerative Medicine) Университета Пенсильвании профессор клеточной биологии и биологии развития Кеннет Зарет (Kenneth Zaret), PhD. (Фото: upenn.edu)
Ученые расшифровывают молекулярные механизмы перепрограммирования клеток
Пятьдесят лет назад британский ученый Джон Гёрдон (John Gurdon) доказал, что генетический материал соматической клетки можно перепрограммировать в эмбриональное состояние, перенеся его в яйцеклетку. В 2006 году Шинья Яманака (Shinya Yamanaka) из Киотского университета (Kyoto University) развил эти представления: в его экспериментах экспрессия четырех белков трансформировала соматические клетки мыши в клетки близкие к эмбриональным стволовым – в так называемые индуцированные плюрипотентные стволовые клетки (induced pluripotent stem cells, iPSCs).
За свои открытия Гёрден и Яманака удостоены Нобелевской премия по физиологии и медицине за 2012 год. Теперь, благодаря работе группы во главе с Кеннетом Заретом (Kenneth Zaret), PhD, из Школы медицины Перельмана (Perelman School of Medicine) Университета Пенсильвании (University of Pennsylvania), ученые могут лучше понять, что представляет собой процесс перепрограммирования клеток в iPSCs и почему метод, разработанный Яманакой, оказался столь неэффективным. Это важный шаг в развития регенеративной медицины.
Результаты проведенного исследования, опубликованного в журнале Cell, выявляют препятствия в получении индуцированных плюрипотентных стволовых клеток, преодоление которых поможет значительно повысить эффективность и скорость генерации iPS-клеток.
Человеческие индуцированные плюрипотентные стволовые клетки получают за счет экспрессии в соматических клетках, например, в клетках кожи, четырех взаимодействующих с ДНК белков – Oct4, Sox2, Klf4 и с-Myc (O, S, K и M соответственно). Как у занимающихся стволовыми клетками ученых, так и у медицинского сообщества эти факторы вызывают повышенный интерес – не в последнюю очередь потому, что позволяют получать клетки со свойствами эмбриональных, не сталкиваясь с этическими и моральными дилеммами. Не менее важно и то, что индуцированные плюрипотентные стволовые клетки, полученные из клеток пациентов с генетическими заболеваниями, могут быть использованы для изучения причин развития этих недугов и разработки препаратов для лечения целого ряда заболеваний, например, болезни Хантингтона и болезни Паркинсона.
Однако процесс получения индуцированных плюрипотентных стволовых клеток крайне неэффективен. Полное перепрограммирование соматических клеток в iPSCs может занять целый месяц, при этом только одна из тысячи клеток станет плюрипотентной. Более того, результаты целого ряда исследований свидетельствуют о том, что при всей своей пластичности iPSCs не являются абсолютным эквивалентом эмбриональных стволовых клеток.
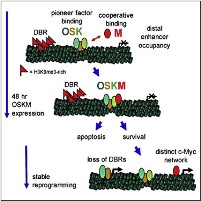
Доктор Зарет и его коллеги проанализировали местоположение этих четырех факторов в геноме фибробластов человека через 48 часов после начала перепрограммирования и сравнили их локализацию в четырех типах клеток: начальной популяции; полностью перепрограммированных индуцированных плюрипотентных клетках; клетках, приближающихся к концу процесса перепрограммирования (пре-iPSCs) и эмбриональных стволовых клетках.
Исследователи установили, что через 48 часов эти факторы, как правило, связываются с регуляторными элементами генов, так называемыми энхансерами, находящимися далеко от регулируемых ими генов, а не с самими генами-мишенями. Это говорит о том, что O, S, K являются «пионерными факторами», открывающими закрытые хроматиновые структуры на самой ДНК и облегчающими процесс перепрограммирования клеток, делая фрагменты-мишени генома доступными для считывания.
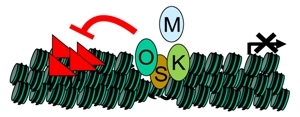
В начале перепрограммирования клетки регуляторные белки Oct4 (O), Sox2 (S) и Klf4 (K) связываются с хромосомами у молчащих генов и делают возможным связывание с-Мус (M). Однако существуют большие хромосомные домены, содержащие особые эпигенетические метки (красные треугольники), препятствующие связыванию O, S, K, M. Удаление этих меток позволяет регуляторным белкам связываться с ДНК и способствует процессу клеточного перепрограммирования. (Фото: Kennet Zaret, PhD, Perelman School of Medicine, University of Pennsylvania)
Кроме того, ученые обнаружили большие области генома, рефракторные к связыванию с факторами перепрограммирования в течение первых 48 часов, которые, однако, в конечном итоге активируются и являются необходимыми для образования индуцированных плюрипотентных стволовых клеток.
«По сути дела, большие фрагменты человеческого генома физически сопротивляются связыванию с этими факторами», - объясняет доктор Зарет. «Это навело нас на мысль о том, что для доставки этих факторов в конечный пункт назначения необходимо преодолеть это препятствие».
Такие рефрактерные последовательности, как правило, химически помечены гистоновой модификацией H3K9me3. Блокирование ферментов, катализирующих синтез этой модификации, значительно ускоряет процесс перепрограммирования клеток.
По мнению доктора Зарета, эти данные выявляют генетические препятствия, замедляющие и затрудняющие процесс перепрограммирования клеток в iPSCs, а также факторы, которые могут лежать в основе тонких различий между индуцированными плюрипотентными и эмбриональными стволовыми клетками. Они же подсказывают и потенциальный способ обойти эти препятствия путем добавления ингибиторов H3K9me3.
Но, по мнению доктора Зарета, эти данные раскрывают и нормальный клеточный механизм, который клетки могут использовать для подавления блоков генов, противоречащих их биологии.
«Мы начали с того, что хотели уточнить механизм перехода клетки к плюрипотентности, но в конечном итоге открыли новые способы управления экспрессией генов путем отключения части ее генома», - подводит итог ученый. brazzers на Sosalka.tv
«Это исследование дает подробную информацию о том, как факторы перепрограммирования взаимодействуют с хроматином дифференцированных клеток и направляют их на путь трансформации в стволовые», - комментирует работу Сьюзан Хейнс (Susan Haynes), PhD, из Национального института общей медицины (National Institute of General Medical Sciences), частично финансировавшего эту работу. «Кроме того, работа доктора Зарета определяет основной структурный барьер в хроматине, который эти факторы должны преодолеть, чтобы связаться с ДНК. Эти знания помогут повысить эффективность перепрограммирования клеток, что очень важно для их будущего терапевтического применения».
По материалам
Penn Study Decodes Molecular Mechanisms Underlying Stem Cell Reprogramming
Оригинальная статья:
Abdenour Soufi, Greg Donahue, Kenneth S. Zaret. Facilitators and Impediments of the Pluripotency Reprogramming Factors' Initial Engagement with the Genome
© «Найдены причины низкой эффективности метода Яманаки». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Стволовые клетки. Письменное разрешение обязательно.
Еще о стволовых клетках
Специфический флуоресцентный маркер для нейральных стволовых клеток
Раскрывая тайны стволовых клеток
Из стволовых клеток эндотелия сосудов выращены функциональные кровеносные сосуды
«Другой» вид стволовых клеток, возможно, сделает регенеративную медицину реальностью
Впервые получены пригодные для терапии сердечно-сосудистые клетки-предшественники
Источником индуцированных плюрипотентных стволовых клеток для лечения сердечно-сосудистых заболеваний стал обычный образец крови
Нейроны можно получать из слущивающегося почечного эпителия
Прорыв в понимании биологии эмбриональных стволовых клеток
Из стволовых клеток получены два типа гладкомышечных клеток сосудов
Хронический миелолейкоз: определен механизм развития лекарственной резистентности раковых стволовых клеток
Related Articles: |













