|
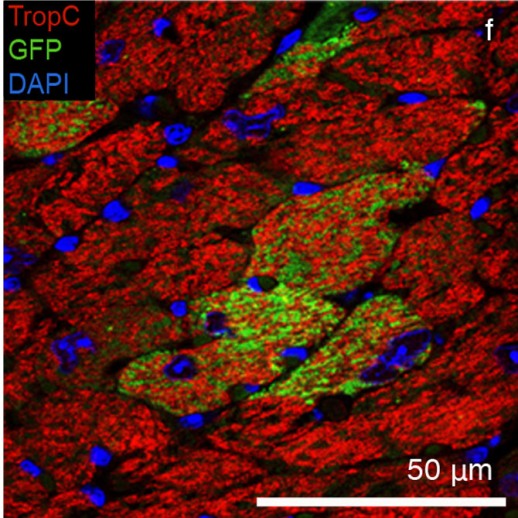
Сердечно-сосудистые прогениторные клетки (зеленые), полученные из помеченных GFP индуцированных плюрипотентных стволовых клеток, введенные в сердце живой мыши (красное), интегрированы в функциональную ткань сердечной мышцы. Ядра клеток помечены синим. (Фото: © Fraunhofer IGB)
По оценкам, каждый год от сердечно-сосудистых заболеваний умирает 17 миллионов человек. Хотя уровень смертности постепенно снижается, инфаркт все еще остается одной из самых частых причин смерти в развитых странах мира. Часто причиной инфаркта является закупорка обеспечивающей сердце кровью коронарной артерии, что убивает кардиомиоциты. Кардиомиоциты – клетки сердечной мышцы, отвечающие за сокращение сердца, – не способны к регенерации. Массовая гибель клеток и ткани в результате инфаркта и крайне ограниченная способность к восстановлению взрослого сердца приводят к нарушению кровоснабжения всех органов, что отрицательно сказывается на качестве жизни пациента. Чтобы заменить погибшие клетки и восстановить функциональную способность сердца после обширного инфаркта, врачам нужны зрелые кардиомиоциты, способные выполнять свою работу так же, как это делают родные клетки взрослого сердца.
Получение таких функциональных кардиомиоцитов из четко идентифицированных сердечно-сосудистых прогениторных клеток (cardiovascular progenitor cells, CPCs) находится в центре внимания группы профессора доктора Кати Шэнке-Лэйланд (Katja Schenke-Layland) из Института инженерии и биотехнологии Фраунгофера (Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik, IGB) в Штутгарте и ее американских коллег Али Нзаира (Ali Nsair), MD, из Калифорнийского университета в Лос-Анджелесе (University of California Los Angeles, UCLA) и профессора Робба Мак-Леллана (Robb MacLellan), MD, из Вашингтонского университета (University of Washington) в Сиэтле. На сегодня ученым удалось идентифицировать такие клетки в организме мышей. Эта работа может революционизировать терапию сердечно-сосудистых заболеваний.
Миокардиальные клетки – так же как эндотелиальные клетки и клетки гладкой мускулатуры – развиваются из сердечно-сосудистых прогениторных клеток в период эмбрионального развития человека и других животных. Поискам путей клинического применения этих клеток посвящено значительное количество исследований. Причиной неудач является то, что маркеры, помогающие идентифицировать CPCs, такие как Islet1 или Nkx2.5, находятся в ядре этих клеток. Использование таких маркеров изменяет клетки, делая их непригодными для терапевтического применения. Поэтому так важно выявление безопасных поверхностных маркеров.
Группа профессора Шэнке-Лэйленд и ее американские коллеги блестяще решили эту задачу: им удалось идентифицировать два маркера, рецепторы Flt1 (VEGFR1) и flt4 (VEGFR3), на поверхности CPCs, с помощью которым эти клетки могут быть четко идентифицированы при полном сохранении их биологической функции. Это открытие позволяет ученым выделять отвечающие клиническим требованиям функционально зрелые сердечно-сосудистые прогениторы.
Воодушевленные успехами в идентификации и выделении живых CPCs, исследователи решили получить эти клетки из индуцированных плюрипотентных стволовых клеток. С этой целью они использовали метод, за разработку которого японский ученый Шинья Яманака (Shinya Yamanaka) был награжден Нобелевской премии по медицине за 2012 год. Его работа, опубликованная всего шесть лет назад, показала, что за эмбриональное состояние клеток отвечают четыре белка. Встроив гены этих четырех белков в дифференцированные – зрелые и специализированные – клетки, доктор Яманака вернул их в эмбриональное состояние. Из этих клеток, названных им индуцированными плюрипотентными стволовыми клетками, ученые могут получать любые клетки организма – гепатоциты, нейроны или кардиомиоциты.
В своем исследовании ученые использовали штамм мышей, у которых клетки помечены зеленым флуоресцентным белком (GFP), видимым под флуоресцентным микроскопом. Клетки этих мышей были перепрограммированы четырьмя генами Яманаки в индуцированные плюрипотентные стволовые клетки, которые легко идентифицируются.
На следующем этапе исследователи культивировали помеченные GFP iPS-клетки в различных условиях, используя влияющие на их развитие растворы ростовых факторов.
«Благодаря нашим вновь установленным поверхностным клеточным маркерам мы смогли обнаружить в культуре и изолировать Flt1- и flt4-позитивные CPCs», - говорит профессор Шэнке-Лэйленд. «При дальнейшем культивировании in vitro выделенные мышиные CPCs действительно развивались – так же как и клетки-предшественники, полученные из эмбриональных стволовых клеток – в эндотелиальные клетки, гладкомышечные клетки и, что более интересно, в функциональные клетки сердечной мышцы».
Но как полученные из индуцированных плюрипотентных стволовых клеток CPCs ведут себя в живых организмах? Действительно ли они могут интегрироваться в ткань и восстановить сердечную мышцу? Чтобы ответить на эти вопросы, ученые ввели помеченные GFP CPCs в сердца живых мышей. Через 28 дней они исследовали эти сердца и увидели, что зеленые флуоресцентные клетки развились в бьющиеся клетки сердечной мышцы и были полностью интегрированы в ткань миокарда.
Ученые уже давно пытаются стимулировать регенерацию клеток миокарда. Для этого они вводят в сердце стволовые клетки или полученные из стволовых клеток кардиомиоциты. Хотя в большинстве случаев зафиксировано некоторое улучшение функции сердца, ни долгосрочной интеграции, ни дифференцировки стволовых клеток в кардиомиоциты так и не было продемонстрировано.
Полученные Шэнке-Лэйленд, Нзаиром и Мак-Ленноном результаты впервые предоставляют возможность получения функциональных клеток сердечной мышцы, способных интегрироваться в миокард.
«Сейчас мы сосредоточились на изучении человеческих iPSCs. Если удастся показать, что сердечно-сосудистые клетки-предшественники, способные созревать в функциональную сердечную мышцу, можно получать из человеческих индуцированных плюрипотентных стволовых клеток, значит, мы действительно нашли решение для пациентов с инфарктом», - надеется ученый.
По материалам
Herzmuskelzellen aus Vorläuferzellen hergestellt – Hoffnung für Herzinfarktpatienten
Оригинальная статья:
Ali Nsair, Katja Schenke-Layland, Ben Van Handel, Denis Evseenko, Michael Kahn, Peng Zhao, Joseph Mendelis, Sanaz Heydarkhan, Obina Awaji, Miriam Vottler, Susanne Geist, Jennifer Chyu, Nuria Gago-Lopez, Gay M. Crooks, Kathrin Plath, Josh Goldhaber, Hanna K. A. Mikkola, W. Robb MacLellan. Characterization and Therapeutic Potential of Induced Pluripotent Stem Cell-Derived Cardiovascular Progenitor Cells
© «Впервые получены пригодные для терапии сердечно-сосудистые клетки-предшественники». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Стволовые клетки. Письменное разрешение обязательно.
Почему человеческое сердце потеряло способность к регенерации?
Еще о стволовых клетках
Специфический флуоресцентный маркер для нейральных стволовых клеток
Раскрывая тайны стволовых клеток
Из стволовых клеток эндотелия сосудов выращены функциональные кровеносные сосуды
«Другой» вид стволовых клеток, возможно, сделает регенеративную медицину реальностью
Найдены причины низкой эффективности метода Яманаки
Источником индуцированных плюрипотентных стволовых клеток для лечения сердечно-сосудистых заболеваний стал обычный образец крови
Нейроны можно получать из слущивающегося почечного эпителия
Прорыв в понимании биологии эмбриональных стволовых клеток
Из стволовых клеток получены два типа гладкомышечных клеток сосудов
Хронический миелолейкоз: определен механизм развития лекарственной резистентности раковых стволовых клеток
Related Articles: |













