|
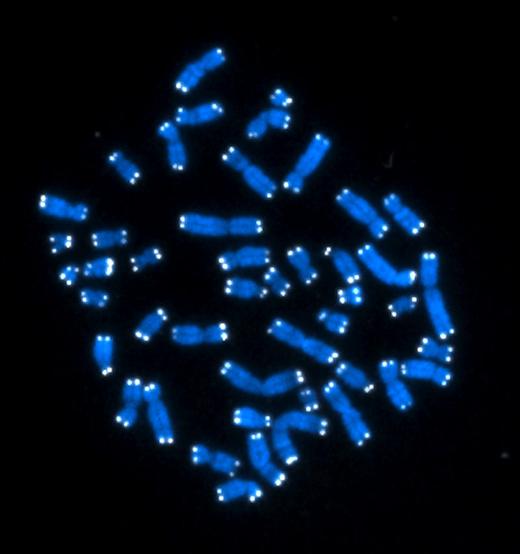
46 хромосом человека (показаны синим) с теломерами на концах (белые точки). Процесс репликации ДНК уже закончен, и каждая хромосома представлена двумя идентичными копиями, каждая из которых обладает двумя собственными теломерами. (Фото: Hesed Padilla-Nash and Thomas Ried)
О теломерах, теломеразе и белке-«вредителе» прогерине
Ученые Национального института здравоохранения (National Institutes of Health) США установили новый молекулярный путь, включающий часы запрограммированного старения нормальных клеток. Проведенное ими исследование вносит много нового в наши представления о взаимодействии между токсичным белком прогерином и защищающими концы хромосом структурами – теломерами.
Теломеры «изнашиваются» в процессе деления клетки. Их значительное укорочение приводит к тому, что клетка в конечном итоге перестает делиться и умирает. Ученые установили, что короткие или потерявшие способность нормально выполнять свою функцию теломеры активируют синтез белка прогерина, связанного с возрастным повреждением клетки. По мере укорочения теломер клетки вырабатывают все больше этого токсичного белка.
Прогерин - мутировавшая версия нормального клеточного белка ламинаA, который кодируется нормальным геном LMNA. Ламин А помогает поддерживать правильную структуру ядра клетки – хранилища генетической информации.
В 2003 году ученые Национального научно-исследовательского института генома человека (National Human Genome Research Institute, NHGRI) открыли, что мутация гена LMNA вызывает редкое заболевание – преждевременное старение, называемое прогерией, или синдромом Хатчинсона-Гилфорда. Прогерия – крайне редкое заболевание, при котором у детей проявляются симптомы, обычно ассоциируемые с пожилым возрастом, включая потерю волос, атрофию подкожно-жировой клетчатки, преждевременное развитие атеросклероза и скелетные аномалии. Обычно такие дети умирают в подростковом возрасте от осложнений сердечно-сосудистых заболеваний.

Директор Национального института здравоохранения (NIH) США Фрэнсис Коллинз (Francis Collins), MD, PhD. (Фото: med.stanford.edu)
«Установление связи между этим редким явлением и нормальным старением приносит свои плоды в очень важной области», - подчеркивает директор NIH Фрэнсис Коллинз (Francis Collins), MD, PhD, старший автор статьи, опубликованной в журнале The Journal of Clinical Investigation. «Мы с самого начала считали, что прогерия может многому нас научить в области нормального старения и дать подсказки о биохимических и молекулярных механизмах более общего характера».
В исследовании, проведенном в 2007 году, ученые NIH показали, что нормальные клетки здоровых людей могут вырабатывать небольшое количество токсичного прогерина, даже если они не несут мутации, вызывающей синдром Хатчинсона-Гилфорда. Чем больше делений прошла клетка, тем короче теломеры и тем больше продукция прогерина. Но загадка оставалась: что запускает выработку токсичного белка?
В настоящем исследовании ученым удалось выяснить, что мутация, вызывающая прогерию, значительно активирует сплайсинг ламина А в направлении выработки токсичного прогерина, приводя ко всем признакам преждевременного старения, проявляющимся у детей с этим заболеванием. Но изменения в сплайсинге LMNA происходят и при отсутствии в этом гене каких-либо мутаций.
Исследование показывает, что укорочение теломер в процессе нормального клеточного деления у людей с нормальным геном ламина как-то изменяет способ, с помощью которого клетка обрабатывает генетическую информацию, когда превращает ее в белок – процесс, называемый сплайсингом РНК. Чтобы создать белок, РНК транскрибируется из генетических инструкций, встроенных в ДНК. Но РНК не несет всю линейную информацию, содержащуюся в ленте ДНК: клетка соединяет вместе сегменты генетической информации, называемые экзонами, которые содержат код для построения белка, и удаляет промежуточные буквы неиспользуемой генетической информации – интроны. Этот механизм, как представляется, изменяется укорочением теломер и оказывает отрицательно влияние на выработку многих белков, важных для целостности цитоскелета. Но, самое главное, изменение в сплайсинге РНК влияет на процессинг (обработку) матричной РНК ламина, что и приводит к накоплению токсичного прогерина.
«Укорочение теломер в процессе клеточного старения играет причинную роль в активации выработки прогерина и ведет к значительным изменениям альтернативного сплайсинга во многих других генах», - говорит ведущий автор статьи Кань Цао (Kan Cao), PhD, доцент кафедры биологии клетки и молекулярной генетики Мэрилендского университета (University of Maryland), США.
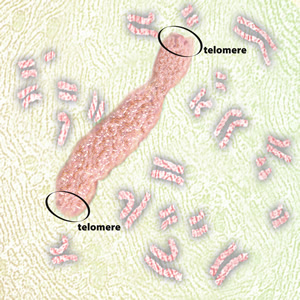
Теломеры защищают концы хромосом. (Фото: genome.gov)
Теломераза – фермент, способный предотвращать укорочение структуры теломер так, что клетки сохраняют способность делиться. (Большинство клеток этого типа – раковые – не достигают конечной точки жизненного цикла нормальной клетки и вместо этого продолжают бесконтрольно размножаться). Показав, что бессмертные клетки с бесконечным запасом теломеразы вырабатывают очень небольшое количество мРНК прогерина, исследование представляет доказательство связи длины теломер с прогерином.
Используя биохимические маркеры, указывающие на продуцирующий прогерин сплайсинг РНК, ученые провели лабораторные тесты и на нормальных клетках здоровых людей. Возраст доноров составлял от 10 до 92 лет. Независимо от возраста, клетки, прошедшие большое количество делений, вырабатывали большее количество прогерина. В нормальных клетках, продуцирующих более высокие концентрации прогерина, наблюдались укороченные и дисфункциональные теломеры – показатель многих пройденных делений.
Помимо изучения синтеза прогерина ученые провели первый систематический анализ альтернативного сплайсинга в процессе старения клетки в масштабах всего генома, рассматривая, какие другие белковые продукты подвергаются воздействию беспорядочных и искаженных инструкций. Используя лабораторные методики, позволяющие проанализировать порядок расположения химических единиц РНК – нуклеотидов – ученые установили, что сплайсинг изменяется короткими теломерами, воздействующими на ламин А и некоторые другие гены, включая те, что кодируют белки, играющие определенную роль в структуре клетки.
Исследователи предполагают, что старение клетки индуцируется сочетанием изнашивания и потери теломер с выработкой прогерина. Это открытие углубляет понимание того, какой вклад прогерин может вносить в процесс нормального старения.
По материалам
NIH researchers find new clues about aging
Оригинальная статья:
Kan Cao, Cecilia D. Blair, Dina A. Faddah, Julia E. Kieckhaefer, Michelle Olive, Michael R. Erdos, Elizabeth G. Nabel, and Francis S. Collins. Progerin and telomere dysfunction collaborate to trigger cellular senescence in normal human fibroblasts
Источник: NanoNewsNet
Еще о старении
Увеличение скорости метаболизма может вести к ускоренному старению
Пониженная температура тела коррелирует с большей продолжительностью жизни
Возрастное сокращение объема мозга человека – плата за большую продолжительность жизни?
Кровь молодых мышей омолаживает мозг старых
Тандем аутофагии и метаболизма жиров оказывает влияние на продолжительность жизни модельных животных C. Elegans
Белок влияет на продолжительность жизни клеток, регулируя длину теломер
Ограничение калорий замедляет процесс старения, предотвращая инактивацию фермента пероксиредоксина
Удаление из организма стареющих клеток может предотвратить развитие возрастных заболеваний
Усиление активности всего одного гена увеличивает продолжительность жизни плодовых мушек на 50 процентов
Дефицит рецепторов инсулиноподобного фактора роста 1 не приводит к увеличению продолжительности жизни мышей
Related Articles: |













