|

Ева и Экхард Мандельков анализируют меченые нейроны. (Фото: © Andreas Garrels)
Химическое соединение, известное как метиленовый синий, является кандидатом на роль препарата для лечения болезни Альцгеймера, так как предотвращает агрегацию тау-белка, характерную для этого заболеванием. Тем не менее, до сих пор механизм этого эффекта оставался неизвестным. Пролить свет на биохимию процесса удалось ученым из Гёттингена и Бонна. Как сообщается в их статье, опубликованной в журнале Angewandte Chemie, метиленовый синий инактивирует молекулы, обеспечивающие связывание тау-белков. Исследование может помочь в разработке новой стратегии создания препаратов для лечения болезни Альцгеймера.
Метиленовый синий – «разносторонне одаренное» вещество с богатой историей. Впервые синтезированное в 1876 году, это соединение с тех пор служит не только как синий краситель, но и как медицинский препарат – например, для лечения малярии и предотвращения инфекций мочевыводящих путей. Сейчас широко обсуждается его использование в качестве потенциального средства для лечения болезни Альцгеймера.
Механизм действия метиленового синего разносторонен. Однако в контексте болезни Альцгеймера важно то, что он предотвращает агрегацию тау-белков. Такие агрегаты характерны для многих форм деменции: белковые сгустки накапливаются в клетках мозга, нарушая их функцию и приводя к гибели.
«Тау-белки очень важны, так как они стабилизируют транспортные молекулярные пути нервных клеток», - объясняет профессор Экхард Мандельков (Eckhard Mandelkow) из Немецкого центра нейродегенеративных заболеваний (Deutschen Zentrum für Neurogenerative Erkrankungen, DZNE) и Научно-исследовательского центра Caesar (Forschungszentrum caesar) в Бонне. «Однако при болезни Альцгеймера они перестают выполнять свою функцию. Внутриклеточные транспортные пути разрушаются, и необходимые для выживания клеток вещества больше не могут добраться до места назначения. Кроме того, тау-белки слипаются. Эти агрегаты также наносят вред клеткам и являются характерным признаком данного заболевания».
Такой сценарий молекулярных событий может быть воспроизведен на животных моделях. Ранее другой группе ученых во главе с доктором Евой-Марией Мандельков (Eva-Maria Mandelkow) удалось доказать, что метиленовый синий смягчает симптомы заболевания у мышей и нематод. Однако доказательств подобного воздействия этого соединения на пациентов с болезнью Альцгеймера до сих пор не собрано. Более того, до настоящего времени оставался неизвестным и механизм наблюдаемого эффекта.
«Метиленовый синий тормозит процесс агрегации, - подчеркивает профессор Экхард Мандельков, - но как это происходит, до сих пор было неясно».
Исследование, опубликованное в Angewandte Chemie, раскрывает суть этого процесса: исследовательская группа Маркуса Цвекштеттера (Markus Zweckstetter) из отделения DZNE в Гёттингене и Института биофизической химии Макса Планка (Max-Planck-Institut für biophysikalische Chemie) в сотрудничестве с группой из Бонна смогли доказать, что метиленовый синий инактивирует аминокислотные остатки, способствующие связыванию тау-белков. Кроме того, исследователи нашли свидетельства того, что это вещество действует как прокладка, держащая белки на расстоянии друг от друга. Эти результаты могут привести к разработке модифицированных форм метиленового синего и новых типов лекарственных средств.

Используя мощный метод изучения биомолекул – ЯМР – немецкие ученые расшифровали механизм действия метиленового синего – потенциального препарата для лечения болезни Альцгеймера. (Фото: E. Akoury)
Решающую роль в данном исследовании сыграла ЯМР-спектроскопия – мощный метод изучения биомолекул.
«Мы установили, что метиленовый синий вступает в реакцию с определенными элементами тау-белков, а именно, цистеинами», – поясняет профессор Цвекштеттер.
Эта реакция весьма эффективна. Метиленовый синий специфически модифицирует тау-белки в важнейших точках: из 441 элемента, составляющего тау-белок, модифицируются, в частности, два цистеина. Непосредственно модифицированными элементами являются так называемые SH-группы, содержащие серу и водород, типичные для цистеина. Теперь с ними связаны атомы кислорода.
«Это химическое превращение предотвращает образование связей между тау-белками», - говорит профессор Цвекштеттер. «В противном случае SH-группы разных белков реагировали бы друг с другом, образуя так называемые дисульфидные мостики. Теперь это невозможно, потому что реакция с метиленовым синим элиминирует SH-группы».
В здоровом организме образование таких дисульфидных мостиков подавляется естественными защитными системами.
«Клетка пытается предотвратить опасные реакции с помощью антиоксидантов», - поясняет профессор Мандельков. «Однако с возрастом и при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, эта защитная система ослабевает, благоприятствуя агрегации тау-белков».
Однако, наряду с образованием дисульфидных мостиков, для агрегации тау-белков важен еще один механизм, подчеркивает профессор Цвекштеттер.
«При образовании дисульфидных мостиков тау-белки агрегируют особенно быстро. Они являются триггерами. Тем не менее, тау-белки могут слипаться и без этих мостиков, хотя и намного медленнее».
Это объясняется структурой молекулы тау, остов которой можно в некоторых местах сложить гармошкой. При сближении двух соответствующим образом ориентированных друг относительно друга белков такие области могут складываться в бета-листы.
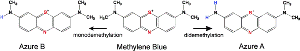
Агрегация тау-белка – одно из ключевых событий в болезни Альцгеймера, и ингибиторы агрегации тау – важные потенциальные лекарственные препараты. Фенотиазины (phenothiazines), такие как метиленовый синий и его дериваты азуры, обладают уникальным механизмом специфической модификации остатков цистеина тау-белка. Эта модификация сохраняет тау в мономерной неупорядоченной конформации, предотвращая образование филаментов и их токсичных предшественников. (Рис. Angewandte Chemie)
«Этот феномен известен очень давно. Метиленовый синий воздействует и на этот механизм. Наши эксперименты показывают его выраженный эффект на области, предрасположенные к образованию бета-листов».
Таким образом, метиленовый синий, и особенно его производные Азур А и Азур B, присутствие которых в физиологических условиях, как ожидается, более предпочтительно, подавляет и агрегацию бета-листов.
«В этом случае образуется стерическое препятствие», - предполагает профессор Цвекштеттер. «Когда это активное вещество присоединяется к области бета-листов тау-белка, с ней уже не может состыковаться ни одна другая молекула тау».
Помимо метиленового синего существуют и другие соединения, способные подавлять агрегацию тау-белка. Некоторые из них однозначно ориентированы на предотвращение образования бета-листов. По мнению немецких ученых, создание эффективного лекарственного средства может, в конечном итоге, потребовать сочетания различных соединений.
«Один из выводов из нашего исследования состоит в том, что существуют различные способы нарушить патогенную агрегацию тау-белка», - резюмирует профессор Цвекштеттер.
По материалам
Forscher entschlüsseln Funktionsweise von potentiellem Wirkstoff gegen Alzheimer
Оригинальная статья:
Elias Akoury, Marcus Pickhardt, Michal Gajda, Jacek Biernat, Eckhard Mandelkow, Markus Zweckstetter. Mechanistic Basis of Phenothiazine-Driven Inhibition of Tau Aggregation
© «Расшифрован механизм подавления агрегации тау-белка метиленовым синим». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Болезнь Альцгеймера. Письменное разрешение обязательно.
Еще о болезни Альцгеймера
Как бета-амилоид ослабляет синаптические связи: новое о NMDA-рецепторе
Из индуцированных плюрипотентных стволовых клеток создана модель болезни Альцгеймера
Экстракт зеленого чая предотвращает образование бета-амилоидных бляшек при болезни Альцгеймера
Визуализация глимфатического пути улучшит раннюю диагностику болезни Альцгеймера
Иммунизация бета-амилоидом подавляет аномальный рост сосудов головного мозга при болезни Альцгеймера
Бета-амилоид является триггером повышения уровня белка, приводящего к дисфункции нейронов при болезни Альцгеймера
Повреждение ДНК происходит в рамках нормальной деятельности мозга
Генетические маркеры указывают на второй путь развития болезни Альцгеймера
Раскрыта одна из главных тайн болезни Альцгеймера
Полифенолы какао противодействуют гибели нейронов при болезни Альцгеймера
Related Articles: |













