|
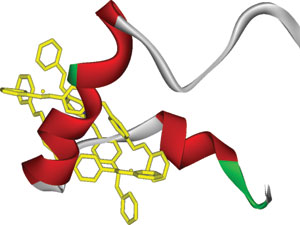
Цилиндрический супермолекулярный комплекс (желтый) взаимодействует с центральной областью β-амилоидного пептида (зелено-бело-красная лента), специфически подавляя его способность к полимеризации. (Рис. Xiaogang Qu)
По мнению исследовательской группы из Китая, супрамолекулярная химия может стать основой нового направления в разработке препаратов для лечения или профилактики болезни Альцгеймера. Найденные учеными супрамолекулярные комплексы способны ингибировать агрегацию β-амилоидного пептида, возможно, являющуюся причиной болезни Альцгеймера, и дестабилизировать уже образовавшиеся бета-амилоидные бляшки.
Болезнь Альцгеймера – наиболее частая причина старческого слабоумия, и, по оценкам, во всем мире ей страдают более 35 миллионов человек – цифра, которая, по прогнозам, утроится к 2050 году. Одним из патологических признаков этого заболевания является полимеризация β-амилоидных пептидов в нерастворимые фибриллярные белковые агрегаты, известные как бета-амилоидные бляшки. Ученые уже давно пытаются разработать ингибиторы агрегации β-амилоидов и использовать эти препараты для лечения и профилактики болезни Альцгеймера. На сегодня большинство известных ингибиторов β-амилоидов – это низкомолекулярные органические соединения или пептиды, многие из которых действуют неспецифически.
Используя новую систему скрининга, основанную на связывании β-амилоида с медленно сворачивающимся флуоресцентным белком, Сяоган Цюй (Xiaogang Qu) и его коллеги из Чанчунского института прикладной химии (Changchun Institute of Applied Chemistry) идентифицировали два трехспиральных металло-супрамолекулярных «цилиндра» ([Ni2L3]4+ and [Fe2L3]4+), способных ингибировать агрегацию β-амилоида за счет специфического связывания с центральной областью пептида (α/β-discordant stretch). Оказалось, что эти цилиндры напоминают так называемые «цинковые пальцы» – небольшие белковые структурные мотивы, стабилизированные одним или несколькими ионами цинка, позволяющие содержащим такой модуль белкам взаимодействовать с другими белками, ДНК и РНК.
![Металло-супрамолекулярные трехспиральные комплексы [Ni2L3]4+ and [Fe2L3]4+, напоминающие по структуре белковые мотивы «цинковые пальцы», способны подавлять агрегацию β-амилоидного пептида – характерный признак болезни Альцгеймера. Эксперименты in vivo показали, что [Ni2L3]4+ and [Fe2L3]4+ снижают уровни нерастворимого β-амилоида и частично восстанавливают пространственную память у трансгенных мышей с моделью болезни Альцгеймера. Это позволяет рассматривать их в качестве потенциальных терапевтических агентов для лечения этого заболевания. Металло-супрамолекулярные трехспиральные комплексы [Ni2L3]4+ and [Fe2L3]4+, напоминающие по структуре белковые мотивы «цинковые пальцы», способны подавлять агрегацию β-амилоидного пептида – характерный признак болезни Альцгеймера. Эксперименты in vivo показали, что [Ni2L3]4+ and [Fe2L3]4+ снижают уровни нерастворимого β-амилоида и частично восстанавливают пространственную память у трансгенных мышей с моделью болезни Альцгеймера. Это позволяет рассматривать их в качестве потенциальных терапевтических агентов для лечения этого заболевания.](/images/stories/supramolecular-complexes-specifically-inhibit-aggregation-of-beta-amyloid-in-Alzheimers-disease/3.gif)
Металло-супрамолекулярные трехспиральные комплексы [Ni2L3]4+ and [Fe2L3]4+, напоминающие по структуре белковые мотивы «цинковые пальцы», способны подавлять агрегацию β-амилоидного пептида – характерный признак болезни Альцгеймера. Эксперименты in vivo показали, что [Ni2L3]4+ and [Fe2L3]4+ снижают уровни нерастворимого β-амилоида и частично восстанавливают пространственную память у трансгенных мышей с моделью болезни Альцгеймера. Это позволяет рассматривать их в качестве потенциальных терапевтических агентов для лечения этого заболевания. (Рис. pubs.rsc.org)
Помимо подавления агрегации β-амилоида эти комплексы дестабилизируют уже образовавшиеся бета-амилоидные бляшки.
«Этот ингибирующий эффект имеет большое значение для предотвращения развития симптомов болезни Альцгеймера на ранней стадии, а эффект дестабилизации приносит большую пользу, обращая болезнь Альцгеймера вспять», - комментирует своей результаты работы Цюй.
«Супрамолекулярная химии дала много уникальной информации о биологических системах, поэтому очень интересно наблюдать дальнейшее расширение сферы ее интересов и включение в нее агрегации β-амилоида и болезни Альцгеймера», – отмечает Захари Менсингер (Zachary Mensinger) из Института нейродегенеративных заболеваний (Institute for Neurodegenerative Diseases) Калифорнийского университета в Сан-Франциско (University of California, San Francisco).
Эксперименты на трансгенных мышах с моделью болезни Альцгеймера показали, что металлосодержащие комплексы [Ni2L3]4+ and [Fe2L3]4+ способны снизить уровень нерастворимого β-амилоида и частично восстановить пространственную память. Однако Тим Сторр (Tim Storr) из Университета Саймона Фрейзера (Simon Fraser University), Канада, отмечает, что вопрос о механизме их действия остается открытым: неизвестно, проникают ли эти катионные комплексы через гематоэнцефалический барьер или оказывают системное воздействие.
По материалам
New supramolecular Alzheimer’s drugs
Оригинальная статья:
Haijia Yu, Meng Li, Gongping Liu, Jie Geng, Jianzhi Wang, Jinsong Ren, Chuanqi Zhao and Xiaogang Qu. Metallosupramolecular complex targeting an α/β discordant stretch of amyloid β peptide
© «Супрамолекулярные комплексы специфически подавляют агрегацию β-амилоида при болезни Альцгеймера». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Болезнь Альцгеймера. Письменное разрешение обязательно.
Еще о болезни Альцгеймера
Ген ApoE4 и болезнь Альцгеймера: повышение проницаемости и смерть сосудов головного мозга
Виновник гибели нейронов при болезни Альцгеймера – апоптоз астроцитов
В мозге пациентов с болезнью Альцгеймера идентифицирована новая группа белков
Болезнь Альцгеймера передается от нейрона к нейрону
Новый взгляд на триггер болезни Альцгеймера
Структура белка С99 подсказывает новое направление в лечении болезни Альцгеймера
Белок-предшественник амилоида способен контролировать свою судьбу
Астроциты образуют глимфатическую систему головного мозга
Фермент ВАСЕ1 наносит двойной удар по памяти
Установлена связь между тау-белком, длиной митохондрий и болезнью Альцгеймера
Related Articles: |













