|
(cognifit.com/post/38170096053)
Болезнь Альцгеймера является наиболее частой причиной деменции у людей старшего возраста. Считается, что это заболевание вызывается накапливающимся в головном мозге белком бета-амилоидом, кластеры которого образуют так называемые бета-амилоидные бляшки, разрушающие нейроны. Заболевание начинает развиваться очень рано – за десятилетия до появления первых клинических признаков.
Разработать препятствующие кластеризации бета-амилоида препараты ученые пытаются в течение многих десятилетий. Такие препараты должны иметь мишень – структуру, взаимодействие с которой предотвращает токсическое действие бета-амилоида.
Исследование, проведенное учеными Калифорнийского университета в Лос-Анджелесе (University of California, Los Angeles, UCLA), показывает, что, хотя мишень для препаратов – бета-амилоидный белок – выбрана правильно, «пули» не попадают в яблочко. Профессор неврологии UCLA Дэвид Теплоу (David Teplow) и его коллеги сосредоточили свое внимание на определенном фрагменте токсичной формы бета-амилоида и открыли уникальную шпилечную структуру, облегчающую его слипание. Статья о результатах исследования опубликована в журнале Journal of Molecular Biology.

Профессор неврологии UCLA Дэвид Теплоу (David Teplow). (Фото: UCLA)
«Каждые 68 секунд кому-то в этой стране ставится диагноз болезни Альцгеймера», - говорит профессор Теплоу, главный научный сотрудник спонсируемого Национальными институтами здравоохранения США (National Institutes of Health, NIH) Центра изучения болезни Альцгеймера (Alzheimer's Disease Research Center) при UCLA. «Болезнь Альцгеймера является единственной из 10 ведущих причин смерти в Америке, которую невозможно предотвратить, вылечить или даже замедлить, если она началась. Большинство разработанных препаратов либо потерпели полную неудачу, либо дают временное смягчение симптомов. Поэтому найти более эффективный молекулярный путь для потенциальных препаратов жизненно важно».
Бета-амилоидный белок состоит из последовательности аминокислот, «очень похожей на жемчужное ожерелье из 20 различных комбинаций разноцветных жемчужин», - объясняет профессор Теплоу. Одна из форм бета-амилоида, Aβ40, состоит из 40 аминокислот, в то время как другая форма, Aβ42, отличается от Aβ40 двумя дополнительными аминокислотами на одном из концов. Aβ42 уже давно считается токсичной формой бета-амилоида, но до сих пор никто не мог объяснить, каким образом простое прибавление двух аминокислот делает ее настолько более токсичной, чем Aβ40.
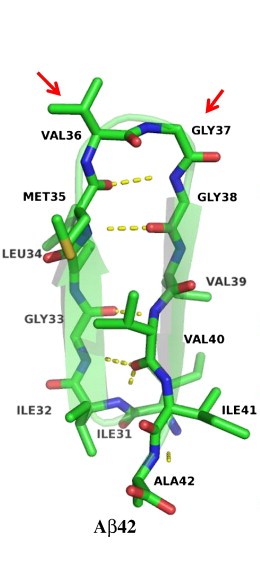
Олигомеризация бета-амилоидного пептида – основополагающее событие в развитии болезни Альцгеймера. С-терминальный изгиб (β-шпилечная структура) делает Aβ42 особенно токсичным и патогенным. Эта структура может быть исключительно важной терапевтической мишенью. Желтой пунктирной линией показаны водородные связи. Атомы C, N, O и S показаны зеленым, синим, красным и желтым, соответственно. Красные стрелки указывают на С-терминальный шпилечный изгиб. (Рис. Journal of Molecular Biology)
Профессор Теплоу и его коллеги решили изучить структуру бета-амилоидных белков с помощью компьютерного моделирования. Сначала ученые создали виртуальный бета-амилоидный пептид, содержащий только последние 12 аминокислот 42-аминокислотного Aβ42. Затем, рассказывает профессор, «мы просто позволили молекуле вращаться в виртуальном пространстве, дав возможность законам физики определять, как каждый атом пептида притягивается к другим атомам или отталкивается от них».
Получив тысячи снимков различных образуемых пептидами молекулярных структур, исследователи определили, какие из них образуются чаще других. Затем на их основе, используя химический синтез, они физически создали мутантные бета-амилоидные пептиды.
«Мы изучили эти мутантные пептиды и установили, что структура, которая делает Aβ42 Aβ42, является шпилечным изгибом в самом конце этого пептида», - говорит профессор Теплоу. «Наша лаборатория первой показала, что именно этот изгиб отвечает за специфическую способность Aβ42 слипаться в сгустки, которые, как мы считаем, убивают нейроны. Белок Aβ40 – короче на две аминокислоты – этого не делает».
Структура шпилечного изгиба ранее не была известна в таких деталях. Ученые надеются, что им удалось найти то, что может быть наиболее релевантной мишенью препаратов для борьбы с болезнью Альцгеймера.
По материалам
Right target, but missing the bulls-eye for Alzheimer's
Оригинальная статья:
Robin Roychaudhuri, Mingfeng Yang, Atul Deshpande, Gregory M. Cole, Sally Frautschy, Aleksey Lomakin, George B. Benedek, David B. Teplow. C-Terminal Turn Stability Determines Assembly Differences between Aβ40 and Aβ42
© «Болезнь Альцгеймера: мишень верна, но пули не попадают в яблочко». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Болезнь Альцгеймера. Письменное разрешение обязательно.
Еще о болезни Альцгеймера
Подтверждена разрушительная роль активации астроцитов при болезни Альцгеймера
Перспективное соединение восстанавливает память у мышей с моделью болезни Альцгеймера
Установлена связь между болезнью Альцгеймера и воспалением
ApoE – идеальная мишень для остановки прогрессии болезни Альцгеймера
Болезнь Альцгеймера: вакцина не за горами
Предложена новая модель прогрессии болезни Альцгеймера
В качестве мишени для лечения болезни Альцгеймера предложен бета-аррестин
Экстракты зеленого чая и красного вина блокируют ключевой шаг в развитии болезни Альцгеймера
Низкобелковая диета восстанавливает когнитивные способности мышей с моделью болезни Альцгеймера
Новая биологическая роль тау-белка?
Related Articles: |













