|

Директор Института геномики и протеомики (Institute of Genomics and Proteomics), профессор химии, биохимии и биологической химии UCLA Дэвид Айзенберг (David Eisenberg). (Фото: Reed Hutchinson/UCLA)
Новое достижение биохимиков Калифорнийского университета – Лос-Анджелес (University of California - Los Angeles) еще на один шаг приблизило ученых к разработке методов лечения, способных задержать начало болезни Альцгеймера и предотвратить передачу ВИЧ половым путем.
Исследователи разработали молекулярные ингибиторы, ориентированные на специфические белки, связанные с болезнью Альцгеймера и ВИЧ, предотвращающие образование амилоидных волокон – удлиненных цепочек белков, играющих ключевую роль в развитии более чем двух десятках дегенеративных и других тяжелейших заболеваний.
«При изучении структуры двух ключевых белков, образующих амилоиды, нам удалось определить небольшую цепочку аминокислот, ответственную за образование амилоидных волокон, и создать «молекулярную шапочку», связывающуюся с концом волокон и подавляющую их рост», - говорит руководитель исследования Дэвид Айзенберг (David Eisenberg), директор Института геномики и протеомики (Institute of Genomics and Proteomics) Министерства энергетики США и Калифорнийского университета в Лос-Анджелесе, научный сотрудник Медицинского института Говарда Хьюза (Howard Hughes Medical Institute).
Исследование опубликовано он-лайн в журнале Nature.
«Это исследование – важный первый шаг к разработке лекарственных препаратов против амилоидных заболеваний, механизм действия которых основан на структуре амилоидных белков», - говорит Дэвид Айзенберг, профессор химии, биохимии и биологической химии UCLA и сотрудник Калифорнийского института наносистем (California NanoSystems Institute) UCLA. «Мы открыли направление, позволяющее университетам и промышленности начать разработку препаратов, которые невозможно было производить 10 лет назад».
Амилоидные волокна – вытянутые водонепроницаемые структуры, образованные двумя связанными между собой белковыми слоями. Белки каждого слоя образуют боковые цепи, сцепляющие слои как зубья молнии.
Такие волокна характерны не только для болезни Альцгеймера, но и для многих других заболеваний, включая болезни Лу Герига (боковой амиотрофический склероз) и Паркинсона, диабет 2 типа и группу неврологических расстройств близких к коровьему бешенству. При болезни Альцгеймера и других нейродегенеративных заболеваниях амилоидные волокна в клетках головного мозга образованы тау-белком. Точный механизм разрушения нейронов все еще остается неизвестным.
Хотя амилоидные волокна характерны для многих заболеваний, болезнь Альцгеймера – самое распространенное из них. Сегодня только в США насчитывается 5 миллионов пациентов с этим диагнозом, а ежегодно регистрируемое число новых случаев приближается к 500000. Расходы на лечение таких пациентов только за текущий год оцениваются в 178 миллиардов долларов, включая стоимость неоплачиваемого ухода за пациентами, предоставленного им 10 миллионами членов их семей и друзей.
Прогнозируется, что к 2050 году количество пациентов с болезнью Альцгеймера достигнет 19 миллионов. По словам профессора Айзенберга, «уход за таким количеством больных с этим тяжелейшим заболеванием составит значительную долю валового внутреннего продукта Соединенных Штатов».
Профессор Айзенберг и его группа установили, что за образование амилоидных волокон ответственна небольшая цепочка всего из шести аминокислот – сокращенно VQIVYK. Изучив структуру волокон с помощью микрокристаллографии – метода, разработанного в UCLA для этого исследования – ученые использовали ее как матрицу для разработки ингибитора, способного предотвратить их дальнейший рост.
Введение полученного ингибитора в раствор тау-белка полностью предотвращало образование амилоидных волокон, подтверждая состоятельность идеи о разработке лекарственных препаратов для амилоидных заболеваний, основанных на структуре амилоидных белков.
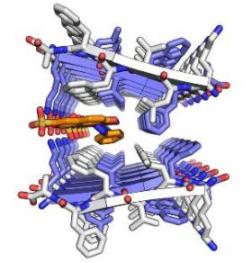
Кристаллическая структура сегмента бета-амилоидного белка, образующего амилоидные волокна при болезни Альцгеймера. Обычно два белковых слоя тесно связаны друг с другом, но в этом случае между ними вклинился «Orang-G». (Рис. David Eisenberg и Meytal Landau)
Несмотря на этот успех, до создания препарата, способного задержать начало болезни Альцгеймера у больных, предстоит пройти еще длинный путь. Ингибитор – цепочка аминокислот – слишком велик, чтобы проникнуть в мозг, где тау-белок образует амилоидные волокна.
«Это исследование является важным шагом на пути к выявлению малых молекул, которые могут быть использованы для разработки терапевтического препарата», - считает профессор Айзенберг. «Наша цель – отсрочить начало болезни Альцгеймера».
В отличие от тау-белка, белок SEVI (semen-derived enhancer of viral infection) - гораздо более доступная для молекулярного блокатора мишень, так как он образует амилоидные волокна во влагалище – ключевой процесс в передаче ВИЧ половым путем.
«Присутствие SEVI делает передачу ВИЧ-инфекции половым путем в 100000 раз более вероятной», - говорит профессор Айзенберг. «Блокируя SEVI, мы блокируем передачу ВИЧ».
Хотя структуры тау-белка и SEVI различны, а функции совершенно не связаны, оба они образуют амилоидные волокна с аналогичной морфологией, что делает возможным разработку двух разных ингибиторов, используя один и тот же процесс, считает ученый.
Ингибитор SEVI, как оказалось, также очень эффективен в предотвращении роста волокон, что подтверждает возможность разработки ингибиторов и для других заболеваний, ассоциированных с амилоидными волокнами.
«Хотя впереди еще множество тестов, кажется, мы недалеки от цели – создания терапевтического препарата», - говорит Айзенберг. «Мы надеемся, что сможем создать блокатор, который можно будет применять в виде вагинального геля или спрея, способного предотвращать ВИЧ-инфекцию».
Ингибиторы тау-белка и SEVI получены с помощью синтетических аминокислот, аналогичных стандартным строительным блокам белков человеческого организма. Но эти синтетические аминокислоты являются зеркальными отражениями естественных или имеют боковые цепи, не встречающиеся в живой природе. Ферменты человеческого организма, «запрограммированные» разрывать белковые цепочки, в принципе неспособны распознавать синтетические аминокислоты, позволяя ингибиторам без помех состыковываться с белками-мишенями.
Это исследование финансировалось из государственного бюджета Национальным институтом здравоохранения (National Institutes of Health), Национальным научным фондом (National Science Foundation) и Министерством энергетики США (U.S. Department of Energy), а также Медицинским институтом Говарда Хьюза (Howard Hughes Medical Institute) и Объединенным центром трансляционной медицины (Joint Center for Translational Medicine).
Вторая исследовательская группа, также во главе с профессором Айзенбергом, сообщает, что ей удалось идентифицировать четыре малые молекулы, взаимодействующие с амилоидными волокнами, включая соединение, названное «Orange-G», которое вклинивается в волокна-молнии и способно разъединить белковые слои.
Исследование опубликовано в PLoS Biology – интернет-журнале Публичной научной библиотеки (Public Library of Science).
«Эти малые молекулы подвержены меньшему риску разрушения в организме и в принципе могут быть модифицированы таким образом, чтобы разрывать амилоидные волокна», - объясняет профессор Айзенберг.
Ученые установили, что «Orange-G» обладает уникальной способностью проникать в непроницаемые «стерические молнии», «застегивающие» гидрофобные амилоидные волокна из бета-амилоидного белка, ответственного за образование сенильных бляшек при болезни Альцгеймера.
«За десять лет мы достигли той точки, когда начинаем понимать структурную биологию амилоидных волокон и то, как подавлять их рост», - говорит Айзенберг. «Следующий шаг – разработать молекулы, подавляющие рост амилоидных волокон и разрывающие их. Это наша конечная цель».
По материалам
Breaking the chain: 'Molecular cap' blocks processes that lead to Alzheimer's, HIV
Оригинальная статья в PloS Biology:
Meytal Landau, Michael R. Sawaya, Kym F. Faull, Arthur Laganowsky, Lin Jiang, Stuart A. Sievers, Jie Liu, Jorge R. Barrio, David Eisenberg. Towards a Pharmacophore for Amyloid
Оригинальная статья в Nature:
Stuart A. Sievers, John Karanicolas, Howard W. Chang, Anni Zhao, Lin Jiang, Onofrio Zirafi, Jason T. Stevens, Jan Münch, David Baker, David Eisenberg. Structure-based design of non-natural amino-acid inhibitors of amyloid fibril formation
© «Разработаны ингибиторы роста амилоидных волокон при болезни Альцгеймера и ВИЧ-инфекции». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на страницу Болезнь Альцгеймера. Письменное разрешение обязательно.
Еще о болезни Альцгеймера
Инсулин как потенциальное средство лечения болезни Альцгеймера
Ацетилирование тау-белка – новый биомаркер болезни Альцгеймера
Болезнь Альцгеймера: бета-амилоидный белок разрушает моторные белки транспортной системы нейронов
Анализ крови для болезни Альцгеймера: дифференциальная диагностика на ранней стадии заболевания
Установлена прямая связь между образованием бета-амилоидных бляшек при болезни Альцгеймера и активностью нейронов головного мозга
Новое о болезни Альцгеймера: два аномальных белка могут работать в тандеме, нарушая структуру и функцию митохондрий нейронов
Новый кандидат на роль препарата для лечения болезни Альцгеймера
Таинственный ингредиент кофе снижает риск болезни Альцгеймера
Полифенолы винограда могут защитить от болезни Альцгеймера
Важный шаг к победе над болезнью Альцгеймера - первая модель протеазы семейства GXGD с атомным разрешением
Related Articles: |













